题目内容
1.反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.下列叙述不正确的是( )| A. | 氧化剂为KMnO4,其中Cl元素被还原 | |
| B. | 若有0.8molH2O生成,则反应中有NA个电子转移 | |
| C. | 浓HCl在反应中起酸性和还原性的作用 | |
| D. | 由此反应可以大胆推测氧化性强弱关系:KMnO4>MnO2 |
分析 2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:A.Mn元素的化合价降低,则反应中KMnO4被还原,氧化剂为KMnO4,其中Cl元素被氧化,故A错误;
B.8mol的水转移10mol的电子,若有0.8molH2O生成,则反应中有NA个电子转移,故B正确;
C.HCl中的氯的化合价升高,是还原剂,所以浓HCl在反应中起酸性和还原性的作用,故C正确;
D.高锰酸钾与浓盐酸反应不需加热,而二氧化锰与浓盐酸反应需加热才发生,所以氧化性强弱关系:KMnO4>MnO2,故D正确;
故选A.
点评 本题考查氧化还原反应,把握氧化还原反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
11.下列化学用语对应正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态18O的电子排布式:1s22s22p63s23p6 | |
| D. | CH4分子的比例模型: |
9.既属于钠盐,有属于硫酸盐的物质是( )
| A. | Na2SO3 | B. | Na2SO4 | C. | K2SO4 | D. | NaHSO4 |
16.下列变化中,加入铁粉不可能实现的是( )
| A. | Ag+→Ag | B. | Fe3+→Fe2+ | C. | H+→H2 | D. | Fe(OH)2→Fe(OH)3 |
6.下列有关叙述正确的是( )
| A. | 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7 | |
| B. | 同体积、同密度的C2H4和CO,两种气体的分子数一定相等 | |
| C. | 配制450ml0.1mol•L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g | |
| D. | 1L0.45mol•L-1NaCl溶液中Cl-的物质的量浓度比0.1L0.15mol•L-1AlCl3溶液大 |
13.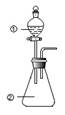 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
向如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ① | ② | 现象 |
| A | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
| B | 氯化铁溶液 | 铁氰化钾溶液 | 产生蓝色沉淀 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 无明显现象 |
| D | 偏铝酸钠 | 稀盐酸 | 立即产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
10.反应 PCl5(g)?PCl3(g)+Cl2(g) ①2HI(g)?H2(g)+I2(g)②在一定条件下,达到化学平衡时,反应物的转化率均是 a%.若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A. | 均增大 | B. | 均不变 | C. | ①增大,②不变 | D. | ①减小,②不变 |
11.氮元素可形成卤化物,叠氮化物及配合物等许多化合物.下列说法不正确的是( )
| A. | NF3分子的空间构型为三角锥形 | |
| B. | 叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-,则N2O与N3-互为等电子体 | |
| C. | 叠氮化物与Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4,则其中钴的配位数为8 | |
| D. | NaN3与KN3的结构类似,则NaN3的晶格能大于KN3的晶格能 |