题目内容
20.下列说法正确的是( )| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| C. | NaCl晶体是由Na+和Cl-组成,NaCl晶体是良导体 | |
| D. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
分析 A.溶液的导电能力与离子的浓度有关,与电解质的强弱无关;
B.H2SO4在溶液中完全电离;
C.NaCl晶体中没有自由电子或自由移动的离子不能导电;
D.氯气和氨气溶于水生成电解质.
解答 解:A.溶液的导电能力与离子的浓度有关,浓度越大导电能力越强,浓度越小导电能力越弱,硫酸钡是强电解质,难溶于水,离子浓度小,导电能力弱,CH3COOH为弱电解质,易溶于水,当乙酸浓度比较大时,离子的浓度大,导电能力强,故A错误;
B.H2SO4是强电解质,溶液中完全电离,所以稀硫酸中没有H2SO4分子,全部以离子形式存在,故B正确;
C.NaCl晶体中没有自由电子或自由移动的离子不能导电,NaCl在水溶液中或熔融状态时才能导电,故C错误;
D.氯气和氨气自身不发生电离不是电解质,溶于水生成电解质,所以溶液能导电,故D错误.
故选B.
点评 本题考查了导电能力大小与强弱电解质的关系,难度不大,注意“导电能力大小与离子浓度有关,与电解质强弱无关”是解答本题的关键.

练习册系列答案
相关题目
11.下列化学用语对应正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态18O的电子排布式:1s22s22p63s23p6 | |
| D. | CH4分子的比例模型: |
5.按碳骨架分类,下列说法正确的是( )
| A. | CH3CH(CH3)2 属于链状化合物 | B. | 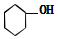 属于酚类化合物 | ||
| C. | 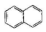 属于苯的同系物 | D. | 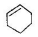 属于芳香族化合物 |
9.既属于钠盐,有属于硫酸盐的物质是( )
| A. | Na2SO3 | B. | Na2SO4 | C. | K2SO4 | D. | NaHSO4 |