题目内容
10.两种元素可以组成AB2型化合物,它们的原子序数可能为( )| A. | 6和8 | B. | 8和13 | C. | 10和14 | D. | 7和12 |
分析 两种元素可以组成AB2型化合物,如果A元素化合价为+4、B元素化合价为-2,则A元素位于第IVA族、B元素位于第VIA族,如果A元素化合价为+2价、B元素化合价为-1价,则A位于第IIA、B位于第VIIA族,据此分析解答.
解答 解:A.6号元素是C元素,8号元素是O元素,C元素位于第IVA族,O元素位于第VIA族,二者能形成AB2型化合物,故A正确;
B.8号元素是O元素,位于第VIA族,13号元素是Al元素,位于第IIIA族,二者能形成A2B3型化合物,故B错误;
C.10号元素是Ne元素,为稀有气体元素,和其它元素不易形成化合物,故C错误;
D.7号元素是N元素,位于第VA族,12号元素是Mg元素,位于第IIA族,二者能形成A3B2型化合物,故D错误;
故选A.
点评 本题考查了元素周期表、原子结构,熟悉元素周期表及原子结构是解本题关键,根据元素化合价确定元素在周期表中的位置,再结合物质间形成化合物来分析解答,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
18.下列有关叙述正确的是( )
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 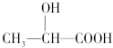 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大 |
5.下列不属于胶体的是( )
| A. | 淀粉在水里形成的透明液体 | |
| B. | 氧化钴(Co2O2)分散在普通玻璃里形成蓝色有机玻璃 | |
| C. | 饱和FeCl3溶液滴入沸水中所形成的红褐色液体 | |
| D. | 将0.1g蔗糖加到10mL蒸馏水中,振荡后形成的无色液体 |
15.下列电子式中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
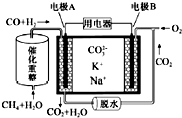

| A. | 电极B为正极,CO2在正极发生还原反应 | |
| B. | 电极A上H2参与的电极反应为:H2+CO32--2e-=CO2↑+H2O | |
| C. | 电极B上发生的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
19.下列反应的能量变化与其他三项不相同的是( )
| A. | 铝粉与氧化铁的反应 | B. | 炽热的炭与二氧化碳的反应 | ||
| C. | 锌片与稀硫酸反应 | D. | 氢氧化钠与盐酸反应 |
20.下列说法中正确的是( )
| A. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| B. | 电子云图中的小黑点密度大,说明该原子核外空间电子数目多 | |
| C. | 光谱分析可用于鉴定元素 | |
| D. | 3d3表示3d能级有3个轨道 |