题目内容
6.下列各组物质中,只用溴水就能鉴别的一组是( )| A. | 甲烷、乙烯、丙烯 | B. | 苯、甲苯、二甲苯 | C. | 甲醇、乙醇、苯酚 | D. | 己烯、苯、苯酚 |
分析 A、乙烯、丙烯与溴水现象相同,都能使溴水褪色;
B、苯、甲苯、二甲苯都能萃取溴水中的溴,而分层;
C、甲醇、乙醇与溴水与溶无明显现象,苯酚与溴水有白色沉淀;
D、己烯与溴水发生加成反应,而使溴水褪色,苯萃取溴水中的溴,而分层,、苯酚与溴水有白色沉淀.
解答 解:A、乙烯、丙烯与溴水现象相同,都能使溴水褪色,乙烯、丙烯不能鉴别,故A不选;
B、苯、甲苯、二甲苯都能萃取溴水中的溴,而分层,油层在上层,现象相同,故B不选;
C、甲醇、乙醇与溴水与溶无明显现象,苯酚与溴水有白色沉淀,所以甲醇、乙醇无法鉴别,故C不选;
D、己烯与溴水发生加成反应,而使溴水褪色,苯萃取溴水中的溴,而分层,、苯酚与溴水有白色沉淀,三者现象不同,可以用溴水鉴别,故D选;
故选D.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的官能团与性质、有机反应现象为解答的关键,侧重分析与应用能力的综合考查,注意常见有机物性质的应用,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
16. “黑索金”是一种烈性炸药.“黑索金”是由乌洛托品(分子结构如图)与发烟硝酸作用制得.下列说法中不正确的是( )
“黑索金”是一种烈性炸药.“黑索金”是由乌洛托品(分子结构如图)与发烟硝酸作用制得.下列说法中不正确的是( )
 “黑索金”是一种烈性炸药.“黑索金”是由乌洛托品(分子结构如图)与发烟硝酸作用制得.下列说法中不正确的是( )
“黑索金”是一种烈性炸药.“黑索金”是由乌洛托品(分子结构如图)与发烟硝酸作用制得.下列说法中不正确的是( )| A. | 乌洛托品中碳原子均达到饱和结构 | |
| B. | 乌洛托品的一氯代物只有一种 | |
| C. | 乌洛托品的分子式为C6H12N4 | |
| D. | 乌洛托品分子结构中含有3个六元环 |
17.把铝粉和Fe2O3粉末配成铝热剂,分成两等份.一份在高温下恰好完全反应后再与足量盐酸反应,另一份直接放入足量的浓烧碱溶液中充分反应.前后两种情况下生成的气体质量比为( )
| A. | 2:1 | B. | 3:2 | C. | 2:3 | D. | 1:1 |
14.某有机物的结构简式为 ,它在一定条件下可能发生的反应是( )
,它在一定条件下可能发生的反应是( )
①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原.
 ,它在一定条件下可能发生的反应是( )
,它在一定条件下可能发生的反应是( )①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原.
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤⑥ | C. | ①③⑤⑥⑦ | D. | ①③④⑤⑦ |
11.下列有关试剂的保存方法,错误的是( )
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| D. | FeSO4溶液中加入少量Fe粉和稀盐酸 |
20.下列叙述正确的是( )
| A. | 由同种元素组成的物质肯定是纯净物 | |
| B. | 一种元素可形成多种离子 | |
| C. | 含有金属元素的离子一定都是阳离子 | |
| D. | 具有相同质子数的粒子都属于同种元素 |

 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$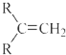 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)  .写出A中含氧官能团的名称:羟基
.写出A中含氧官能团的名称:羟基 或
或 .(不考虑环状结构)
.(不考虑环状结构) .
.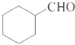 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.