题目内容
17.把铝粉和Fe2O3粉末配成铝热剂,分成两等份.一份在高温下恰好完全反应后再与足量盐酸反应,另一份直接放入足量的浓烧碱溶液中充分反应.前后两种情况下生成的气体质量比为( )| A. | 2:1 | B. | 3:2 | C. | 2:3 | D. | 1:1 |
分析 把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,由反应方程式可知生成n(Fe)=n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知,n(H2)=n(Fe);令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),据此计算判断.
解答 解:把铝粉和Fe2O3粉末配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,由反应方程式可知生成n(Fe)=n(Al),所以n(H2)=n(Al);
令一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n′(H2)=3n(Al),所以n′(H2)=$\frac{3n}{2}$n(Al).
故两种情况下生成气体的物质的量之比为n(H2):n′(H2)=n(Al):$\frac{3n}{2}$n(Al)=2:3,
故选C.
点评 本题考查混合物的计算、根据方程式的计算,难度中等,本题采取电子转移守恒计算,比根据方程式简单容易,清楚反应过程是关键,注意混合物的计算中守恒的运用.

练习册系列答案
相关题目
7.下列各组离子中,在溶液中能大量共存的是( )
| A. | CO32-、Cl-、Na+、H+ | B. | Al3+、K+、OH-、SO42- | ||
| C. | Ba2+、NO3-、SO42-、H+ | D. | K+、Al3+、SO42-、NO3- |
8.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
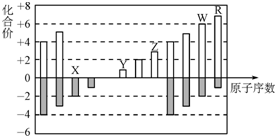

| A. | 离子半径:X>Y>Z | |
| B. | WX3和水反应形成的化合物是离子化合物 | |
| C. | 最高价氧化物对应的水化物酸性:R>W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
12.下列各组物质中,可用溴水溶液来鉴别的是( )
| A. | 乙烯与乙炔 | B. | 乙烯与甲烷 | C. | 苯与直馏汽油 | D. | 苯与CCl4 |
2.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的主要作用力依次是( )
| A. | 范德华力、范德华力、氢键 | B. | 范德华力、范德华力、共价键 | ||
| C. | 共价键、共价键、共价键 | D. | 范德华力、氢键、共价键 |
9.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④还原性:I->Br->Cl-.
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④还原性:I->Br->Cl-.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
6.下列各组物质中,只用溴水就能鉴别的一组是( )
| A. | 甲烷、乙烯、丙烯 | B. | 苯、甲苯、二甲苯 | C. | 甲醇、乙醇、苯酚 | D. | 己烯、苯、苯酚 |