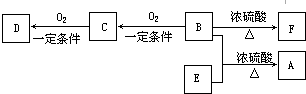
题目内容
6.目前用于制造环保餐具的一种生物塑料是PHB,它的最大特点是废弃物易于处理,其结构式为 ,下列关于PHB的叙述中不正确的是( )
,下列关于PHB的叙述中不正确的是( )| A. | 它能发生水解反应 | |
| B. | 它在微生物作用下可降解成CO2和水 | |
| C. | 它可能是由一种含羟基的羧酸经缩聚反应而得 | |
| D. | 制备它的单体为HCOOH和CH3CH2CH2OH |
分析  为缩聚产物,易降解,单体为CH3CH2CHOHCOOH,以此解答该题.
为缩聚产物,易降解,单体为CH3CH2CHOHCOOH,以此解答该题.
解答 解:A.含有酯基,可发生水解,故A正确;
B.为环保材料,可降解生成二氧化碳和水,故B正确;
C.由高聚物结构简式可知可能是由一种含羟基的羧酸经缩聚反应而得,故C正确;
D.单体为CH3CH2CHOHCOOH,故D错误.
故选D.
点评 本题考查有机物结构和性质,为高考常见题型,侧重考查学生的分析能力,把握官能团及其性质关系即可解答,侧重考查基本概念及物质结构,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.短周期元素X和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,则m和n不可能的关系是( )
| A. | m-13=n | B. | n+5=m | C. | m+8=n | D. | n-11=m |
18.如表是实验室制备气体的有关内容:
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是Cl2(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是SO2;
(2)根据表中所列实验原理,从如图1装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如图2实验,将氯气依次通过下列装置以验证氯气的性质:
①通入氯气后,A中的现象是溶液变蓝色,整套实验装置存在的明显缺陷是无尾气吸收装置;
②C装置中发生反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化.具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化.你认为否 (填“是”或“否”)合理?
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制备氧气 | H2O2→O2 | Ⅲ |
| ② | 制备二氧化硫 | Na2SO3→SO2 | Ⅲ |
| ③ | 制备氯气 | HCl→Cl2 | Ⅰ或Ⅲ |
(2)根据表中所列实验原理,从如图1装置中选择合适的气体发生装置,将其编号填入上表中的空格中.

(3)某学习小组设计了如图2实验,将氯气依次通过下列装置以验证氯气的性质:
①通入氯气后,A中的现象是溶液变蓝色,整套实验装置存在的明显缺陷是无尾气吸收装置;
②C装置中发生反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化.具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化.你认为否 (填“是”或“否”)合理?
15.如表列出了①~⑧八种元素在周期表中的位置:
请按要求回答下列问题:
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是NaOH(填写化学式).
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为K>Na>Mg(用元素符号表示).
(3)元素①的气态氢化物的电子式是 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)元素⑨的原子结构示意图是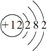 .
.
元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的半导体材料.
(5)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(6)用离子方程式证明⑦⑧两元素非金属性的强弱Cl2+2Brˉ═Br2+2Clˉ.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑦ | |||
| 4 | ⑥ | ⑧ |
(1)②、③、④三种元素的最高价氧化物对应的水化物,其中碱性最强的是NaOH(填写化学式).
(2)②、③、⑥三种元素按原子半径由大到小的顺序排列为K>Na>Mg(用元素符号表示).
(3)元素①的气态氢化物的电子式是
 .写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
.写出实验室里制取该气体的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(4)元素⑨的原子结构示意图是
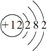 .
.元素⑤的单质的导电性介于导体和绝缘体之间,因此是一种良好的半导体材料.
(5)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(6)用离子方程式证明⑦⑧两元素非金属性的强弱Cl2+2Brˉ═Br2+2Clˉ.

 .
. .
. .
. .
. (写结构简式):
(写结构简式):