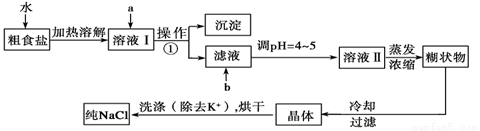
题目内容
1.在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )| A. | SiO2、N2O5、CO、Cl2 | B. | Al2O3、Cl2、N2O5、SO3 | ||
| C. | CO2、Al(OH)3、CaO、SO2 | D. | Al2O3、CO2、SO3、SO2 |
分析 酸性氧化物和过量氢氧化钠溶液反应生成正盐,氯气和氢氧化钠溶液反应生成钠盐,铝、氧化铝和氢氧化钠溶液反应生成偏铝酸钠,据此分析.
解答 解:A.SO2与足量NaOH溶液反应生成的盐为亚硫酸钠;N2O5与足量NaOH溶液反应生成的盐为硝酸钠;C12与足量NaOH溶液反应生成的盐为氯化钠和次氯酸钠;CO与NaOH溶液不反应,故A总共4种盐;
B.Al2O3与足量氢氧化钠反应生成的盐为偏铝酸钠;C12与足量NaOH溶液反应生成的盐为氯化钠和次氯酸钠;N2O5与足量NaOH溶液反应生成的盐为硝酸钠;SO3与足量NaOH溶液反应生成的盐为硫酸钠,故B总共5种盐;
C.CO2与足量NaOH溶液反应生成的盐为碳酸钠;Al(OH)3与足量氢氧化钠反应生成的盐为偏铝酸钠;CaO与NaOH不反应,与水反应生成氢氧化钙;SO2与足量NaOH溶液反应生成的盐为亚硫酸钠;故C总共3种盐;
D.Al2O3与足量氢氧化钠反应生成的盐为偏铝酸钠;CO2与足量NaOH溶液反应生成的盐为碳酸钠;SO3与足量NaOH溶液反应生成的盐为硫酸钠;SO2与足量NaOH溶液反应生成的盐为亚硫酸钠,故D总共4种盐;
综上可知,B正确;
故选B.
点评 本题考查物质的性质,明确物质之间的反应是解本题关键,注意部分酸性氧化物和碱反应与其量有关,题目难度不大,侧重于考查学生对基础知识的应用能力.

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 原子 | B. | 分子 | C. | 阳离子 | D. | 阴离子 |
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 将某有机物滴入高锰酸钾溶液中 | 高锰酸钾溶液褪色 | 该有机物一定含不饱和键 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向某淡黄色试液X中滴加少许NaOH溶液 | 试液X中出现红褐色沉淀 | 说明试液X中一定含有FeCl3 |
| D | 向装有少许无水硫酸铜的试管中加入乙醇 | 固体由白变蓝 | 该乙醇中一定含有水 |
| A. | A | B. | B | C. | C | D. | D |
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞 |
B.用标准溶液润洗滴定管2-3次 |
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液 |
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm |
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)B-
(2)滴定开始后,眼睛注视 ,判断到达终点的现象是 。
(3)下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
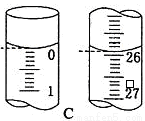
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。
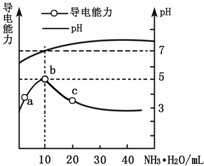 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | b点溶液pH=5,此时酸碱恰好中和 | |
| B. | a~b点导电能力增强,说明HR为弱酸 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
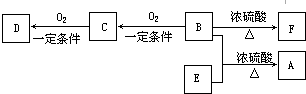
 SO3(g)的平衡常数K1=20,在同一温度下,反应2SO3(g)
SO3(g)的平衡常数K1=20,在同一温度下,反应2SO3(g)