题目内容
15.高炉炼铁中存在反应:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,下列说法正确的是( )| A. | CO是氧化剂 | B. | CO是还原剂 | ||
| C. | CO既是氧化剂又是还原剂 | D. | CO既不是氧化剂又不是还原剂 |
分析 根据元素化合价升高,作还原剂,化合价降低,作氧化剂,即升高又降低既是氧化剂又是还原剂分析.
解答 解:高炉炼铁中存在反应:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,CO中的C元素化合价由+2价升高到+4价,则仅作还原剂,故选:B.
点评 本题主要考查了氧化还原反应的基本概念,难度不大,注意根据化合价变化来判断.

练习册系列答案
相关题目
5.图1是硫元素在自然界的循环情况.
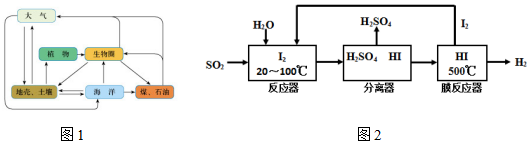
(1)有关叙述中不正确的是ac(填序号)
a.自然界不存在游离态的硫
b.部分硫元素由地壳到大气的过程发生了氧化反应
c.图1显示大气中的二氧化硫最终回到海洋并很快和其它矿物形成煤和石油
d.葡萄酒中含有二氧化硫可防止葡萄酒被氧化
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2而获得清洁能源.
①该循环工艺过程的总反应方程式为SO2+2H2O=H2+H2SO4.
②FeS2可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式
③用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是减小生成物浓度,平衡正向移动,提高HI的分解率.
④已知下列三个反应:
a Cl(g)+H(g)═HCl(g)△H1 b Br(g)+H(g)═HBr(g)△H2 c I(g)+H(g)═HI(g)△H3
则△H1、△H2、△H3由大到小的顺序为△H3>△H2>△H1,用原子结构解释原因Cl、Br、I为同主族元素,从上至下,原子半径依次知道,非金属性依次减弱,氢化物稳定性依次减弱.
(3)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
表是不同压强、温度时SO2的转化率情况.
工业中SO2转化为SO3通常采用400℃~500℃、压强1.0MPa,而不选择更高的10MPa.其原因是压强增大10倍,转化率几乎不变.
(4)下列事实能说明H2SO3的酸性强于H2CO3的是b
a.饱和H2SO3溶液的pH小于饱和H2CO3溶液的pH.
b.同温下,等浓度的NaHSO3和NaHCO3溶液,后者的pH值大.
c.H2SO3能使酸性高锰酸钾溶液褪色,而H2CO3不能.
d.将过量SO2气体通入NaHCO3溶液中,逸出的气体能使澄清石灰水变浑浊.

(1)有关叙述中不正确的是ac(填序号)
a.自然界不存在游离态的硫
b.部分硫元素由地壳到大气的过程发生了氧化反应
c.图1显示大气中的二氧化硫最终回到海洋并很快和其它矿物形成煤和石油
d.葡萄酒中含有二氧化硫可防止葡萄酒被氧化
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2而获得清洁能源.
①该循环工艺过程的总反应方程式为SO2+2H2O=H2+H2SO4.
②FeS2可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式

③用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是减小生成物浓度,平衡正向移动,提高HI的分解率.
④已知下列三个反应:
a Cl(g)+H(g)═HCl(g)△H1 b Br(g)+H(g)═HBr(g)△H2 c I(g)+H(g)═HI(g)△H3
则△H1、△H2、△H3由大到小的顺序为△H3>△H2>△H1,用原子结构解释原因Cl、Br、I为同主族元素,从上至下,原子半径依次知道,非金属性依次减弱,氢化物稳定性依次减弱.
(3)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
表是不同压强、温度时SO2的转化率情况.
压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
(4)下列事实能说明H2SO3的酸性强于H2CO3的是b
a.饱和H2SO3溶液的pH小于饱和H2CO3溶液的pH.
b.同温下,等浓度的NaHSO3和NaHCO3溶液,后者的pH值大.
c.H2SO3能使酸性高锰酸钾溶液褪色,而H2CO3不能.
d.将过量SO2气体通入NaHCO3溶液中,逸出的气体能使澄清石灰水变浑浊.
6.下列实验“操作和现象”与“结论”对应且正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | 将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色 | 氧化性:Br2>I2 |
| B | 常温下,打磨后的铝片放入HNO3中,无明显现象 | 常温下,铝不与浓HNO3反应 |
| C | 向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
10.下列醇不能由烃和水加成制得的是( )
| A. | 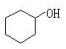 | B. | 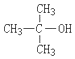 | C. | 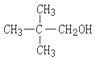 | D. | 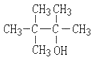 |
5.常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL 0.1000mol/L的两种一元碱MOH、ROH溶液中,PH随盐酸溶液体积的变化如图所示.下列说法正确的是( )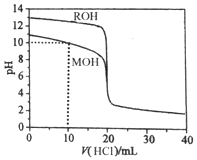

| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
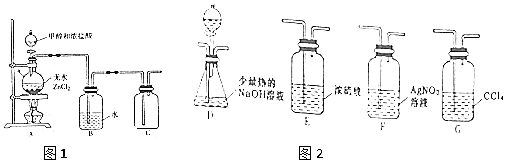
6.利用下列实验装置及药品能完成相应实验的是( )
| A. | 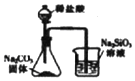 如图用于证明非金属性强弱:Cl>C>S | |
| B. |  如图用于分离I2和NH4Cl | |
| C. |  如图用于测定某NaOH溶液的浓度 | |
| D. | 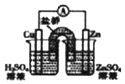 如装置能组成Cu-Zn原电池 |
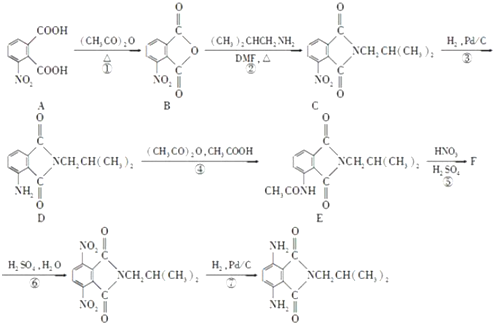
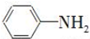 )有还原性,易被氧化;
)有还原性,易被氧化;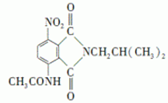 .
.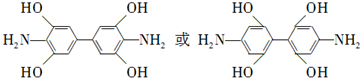 .
.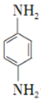 是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下: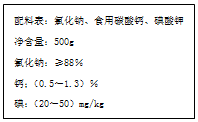 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题: