题目内容
15.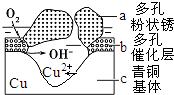 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.(1)原子序数为29的铜元素位于元素周期表中第四周期ⅠB族;
(2)研究发现,腐蚀严重的青铜器表面大都存在CuCl.关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是AB;
A.降低了活化能 B.增大了反应速率 C.降低了反应的焓变 D.增大了平衡常数
(3)采用“局部封闭法”可以防止青铜器进一步被腐蚀.如将糊状Ag2O涂在被腐蚀部位,Ag2O与CuCl发生复分解反应,该化学方程式为Ag2O+2CuCl=2AgCl+Cu2O;
(4)如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.
①腐蚀过程中,负极是c(填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓.
分析 (1)核外电子排布式为1s22s22p63s23p63d104s1,由此判断位置;
(2)A.催化剂降低了反应的活化能,增大活化分子百分数;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会;
C.催化剂改变反应路径,但焓变不变;
D.平衡常数只与温度有关;
(3)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物;
(4)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀.
解答 解:(1)原子核外电子层数与其周期数相等,核外电子排布式为1s22s22p63s23p63d104s1,位于元素周期表的第4周期ⅠB族,故答案为:第四周期ⅠB族;
(2)A.催化剂降低了反应的活化能,增大活化分子百分数,故A正确;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会,所以反应速率增大,故B正确;
C.催化剂改变反应路径,但焓变不变,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,与催化剂无关,故D错误;
故选AB;
(3)Ag2O与有害组分CuCl发生复分解反应,则二者相互交换成分生成另外的两种化合物,反应方程式为Ag2O+2CuCl=2AgCl+Cu2O,
故答案为:Ag2O+2CuCl=2AgCl+Cu2O;
(4)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓.
点评 本题考查Cu及其化合物的性质,为高频考点,把握电子排布、化学反应速率及平衡、电化学反应原理等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸.
(2)写出下列反应的离子方程式
A+BCO32-+Ba2+=BaCO3↓,A+DCO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.请设计实验证明其发生了反应取少量Ba(OH)2溶液滴入几滴酚酞试液,溶液显红色,向该红色溶液中加入稀盐酸至过量,溶液变为无色,说明酸碱发生反应.(试剂任选)
| A. | 6 | B. | 7 | C. | 10 | D. | 14 |
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
| A. | 从左向右数第六纵行是ⅥA族 | B. | 七个周期18个族 | ||
| C. | ⅠA族全部是金属元素 | D. | 所含元素种类最多的族是ⅢB族 |
| A. | 充入氮气 | B. | 减小压强,扩大容器体积 | ||
| C. | 加入催化剂 | D. | 适当升高温度 |
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3 和NaHCO3 | D. | NaOH和Na2CO3 |


 .
. 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题: