题目内容
6.抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质.(1)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉.写出该抗酸药发挥功效时的化学方程式MgCO3+2H+=Mg2++H2O+CO2↑、Al(OH)3+3H+═Al3++3H2O.
(2)淀粉在抗酸药中作填充剂、黏合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)C6H12O6.
(3)服用抗酸药时,一般要嚼碎后吞服.请分析其原因:嚼碎后能增大固体表面积,加快反应速率.
分析 (1)根据抗酸药物有效成分能中和胃里过多的盐酸分析;碳酸镁和盐酸反应生成氯化镁和水、二氧化碳,氢氧化铝和盐酸反应生成氯化铝和水;
(2)根据淀粉在人体内在酶的作用水解最终转化成葡萄糖判断;
(3)嚼碎后能增大固体表面积.
解答 解:(1)碳酸镁、氢氧化铝都能中和胃里过多的盐酸;碳酸镁与盐酸反应生成氯化镁、二氧化碳气体和水,碳酸镁需要保留化学式,反应的离子方程式为MgCO3+2HCl=MgCl2+H2O+CO2↑,氢氧化铝和盐酸反应生成氯化铝和水,反应的离子方程式为:Al(OH)3+3HCl═AlCl3+3H2O,故答案为:MgCO3+2H+=Mg2++H2O+CO2↑;Al(OH)3+3H+═Al3++3H2O;
(2)淀粉在人体内在酶的作用水解最终转化成葡萄糖,其分子式为:C6H12O6,故答案为:C6H12O6;
(3)嚼碎后能增大固体表面积,从而能加快与胃酸的反应速率.答:嚼碎后能增大固体表面积,加快反应速率.
点评 本题较为综合,主要考查酸碱盐之间的复分解反应及化学方程式的书写等知识,注意利用化学知识来解决生活中的问题,注意化学方程式的书写重要知识点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.在标准状况下,等质量的CH4和CO2比较,下列说法中正确的是( )
| A. | 密度比4:11 | B. | 分子数之比为4:11 | ||
| C. | 体积比4:11 | D. | 物质的量之比为4:11 |
11.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Mg2+、MnO4-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | K+、Na+、AlO2-、NO3- | D. | Mg2+、K+、HCO3-、OH- |
18.下列说法中,正确的是( )
| A. | 在紫外线、饱和(NH4)2SO4溶液、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 | |
| B. | 用新制Cu(OH)2悬浊液可鉴别麦芽糖和蔗糖 | |
| C. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,震荡,若有油滴浮在液面上,说明油脂已完全反应 | |
| D. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
15.已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系.下列说法错误的是( )
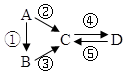

| A. | 若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染.则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO | |
| B. | 若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化.在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H1、△H 2、△H 3,则它们之间的关系为△H 2=△H1+△H 3 | |
| C. | 若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑ | |
| D. | 若A是应用最广泛的金属.④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸 |
4.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在0.2 mol•L-1的Na2CO3溶液中含有Na+的数目为0.4NA | |
| B. | 0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3 NA | |
| C. | 15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA | |
| D. | 标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA |
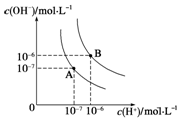 水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1.
水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1.