题目内容
12.下列实验方法能达到实验目的是( )| A. | 用分液漏斗从食醋中分离出乙酸 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH溶液除去Cl2中含有的少量HCl | |
| D. | 用KSCN溶液检验FeCl3溶液 中是否含有Fe3+ |
分析 A.食醋为乙酸溶液,不分层;
B.焰色反应为元素的性质;
C.二者均与NaOH反应;
D.铁离子与KSCN溶液结合生成络离子,为血红色.
解答 解:A.食醋为乙酸溶液,不分层,不能利用分液漏斗分离,应选蒸馏法,故A错误;
B.焰色反应为元素的性质,则焰色反应不能鉴别Na2SO4和Na2CO3,可选盐酸鉴别,故B错误;
C.二者均与NaOH反应,不能除杂,应选饱和食盐水、洗气,故C错误;
D.铁离子与KSCN溶液结合生成络离子,为血红色,则用KSCN溶液检验FeCl3溶液 中是否含有Fe3+,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、物质鉴别、离子检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列实验的原理用离子方程式表示正确的是( )
| A. | 向用NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | NaHSO4为离子化合物在熔融状态下能导电:NaHSO4=Na++H++SO42- | |
| C. | FeCl3腐蚀铜制印刷电路板:Fe3++Cu=Fe2++Cu2+ | |
| D. | NH4Cl溶液显酸性是因为NH4+发生水解:NH4++2H2O?NH3•H2O+H3O+ |
3.将下列物质按酸、碱、盐分类排列,正确的是( )
| A. | 硫酸、纯碱、食盐 | B. | 硝酸、烧碱、胆矾 | ||
| C. | 碳酸、石灰石、蔗糖 | D. | 磷酸、熟石灰、苛性钾 |
20.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
7.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质.下列实验现象和结论一定正确的是( )
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 向氯水中滴加石蕊试液,溶液先变红后褪色,说明溶液中有盐酸和次氯酸 | |
| C. | 加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
1.在标准状况下,等质量的CH4和CO2比较,下列说法中正确的是( )
| A. | 密度比4:11 | B. | 分子数之比为4:11 | ||
| C. | 体积比4:11 | D. | 物质的量之比为4:11 |
2.蒸发海水得到的食盐中,主要含有的可溶性杂质离子除Mg2+、SO42-外,还有( )
| A. | Ca2+ | B. | CO32- | C. | Ba2+ | D. | Al3+ |
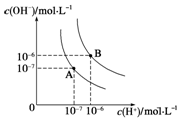 水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1.
水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1.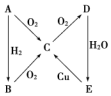 根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式:
根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式: