题目内容
3.下列各种冶炼方法中,可制得相应金属的为( )| A. | 加热氧化镁 | B. | 加热碳酸钙 | ||
| C. | 电解饱和氯化钠溶液 | D. | 电解熔融氯化镁 |
分析 金属的冶炼方法有电解法、热还原法、热分解法等,电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得.
解答 解:A.镁性质活泼,氧化镁性质稳定,加热氧化镁不能制取金属铝镁,应采用电解熔融氯化镁的方法制取镁,故A错误;
B.加热碳酸钙得到氧化钙和二氧化碳,钙性质活泼,应用电解熔融氯化钙的方法制取钙,故B错误;
C.电解饱和食盐水得到氢氧化钠和氯气、氢气,得不到钠,钠性质活泼,应用电解熔融氯化钠制取钠,故C错误;
D.镁性质活泼,应采用电解熔融氯化镁的方法制取镁,故D正确;
故选:D.
点评 本题考查了金属的冶炼方法,金属的活泼性不一样,金属的冶炼方法也是不一样的,熟悉金属活泼性是解题关键,题目难度不大.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
14.下列分散系属于胶体的是( )
| A. | FeCl3溶液 | B. | CuSO4溶液 | C. | 碘酒 | D. | 有色玻璃 |
11.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 苏打 | 水 | 氨气 |
| B | 氢氧化钡 | 氢氧化铁胶体 | 硫酸钡 | 氨水 | 乙醇 |
| C | 明矾 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| D | 石灰石 | 水玻璃 | 氯化钙 | 氢氧化铝 | 碳酸钙 |
| A. | A | B. | B | C. | C | D. | D |
13.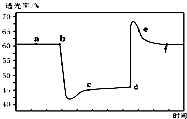 已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
 已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )| A. | b点的操作是快速压缩注射器 | |
| B. | c点与a点相比,c(NO2)、c(N2)都增大 | |
| C. | e点:υ(正)<υ(逆) | |
| D. | 若考虑体系温度变化,且没有能量损失,则平衡常数K(c)>K(f) |
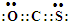 .
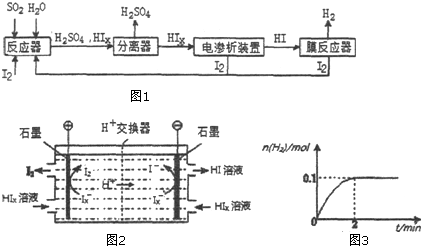
.
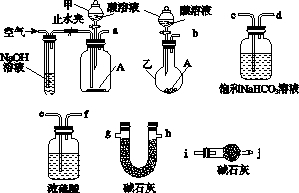 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
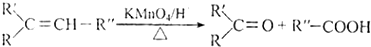
 .
. .
.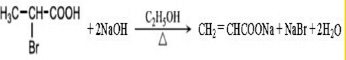 .
. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).