题目内容
室温下,下列溶液的离子浓度关系错误的是( )
| A、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| B、NaHSO4 溶液:c(H+)=c(SO42-)+c(OH-) |
| C、pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+ )>c(OH-) |
| D、Na2S溶液:c(Na+ )=2c(HS-)+2c(S2-)>2c(H2S) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.H2C2O4为二元弱酸,溶液中还存在草酸根离子;
B.硫酸氢钠为强电解质,溶液中完全电离出钠离子、氢离子和硫酸根离子,根据物料守恒和电荷守恒判断;
C.氨水为弱碱,两溶液混合后氨水过量,溶液显示碱性,则c(OH-)>c(H+)、c(NH4+ )>c(Cl-);
D.根据硫化钠溶液中的物料守恒及盐的水解程度大小分析.
B.硫酸氢钠为强电解质,溶液中完全电离出钠离子、氢离子和硫酸根离子,根据物料守恒和电荷守恒判断;
C.氨水为弱碱,两溶液混合后氨水过量,溶液显示碱性,则c(OH-)>c(H+)、c(NH4+ )>c(Cl-);
D.根据硫化钠溶液中的物料守恒及盐的水解程度大小分析.
解答:
解:A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故A错误;
B.NaHSO4 溶液中,根据物料守恒可知:c(Na+)=c(SO42-),结合电荷守恒可得:c(H+)=c(SO42-)+c(OH-),故B正确;
C.pH=2的盐酸与pH=12的氨水等体积混合,氨水为弱碱,则氨水过量,所得溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+ )>c(Cl-),溶液中正确的离子浓度关系为:c(NH4+ )>c(Cl-)>c(OH-)>c(H+),故C错误;
D.根据物料守恒可知:c(Na+ )=2c(HS-)+2c(S2-)+2c(H2S),硫离子水解程度较小,则c(H2S)<c(S2-),故D正确;
故选AC.
B.NaHSO4 溶液中,根据物料守恒可知:c(Na+)=c(SO42-),结合电荷守恒可得:c(H+)=c(SO42-)+c(OH-),故B正确;
C.pH=2的盐酸与pH=12的氨水等体积混合,氨水为弱碱,则氨水过量,所得溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+ )>c(Cl-),溶液中正确的离子浓度关系为:c(NH4+ )>c(Cl-)>c(OH-)>c(H+),故C错误;
D.根据物料守恒可知:c(Na+ )=2c(HS-)+2c(S2-)+2c(H2S),硫离子水解程度较小,则c(H2S)<c(S2-),故D正确;
故选AC.
点评:本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意明确电荷守恒、物料守恒、质子守恒的含义,选项C为易错点,注意氨水为弱碱,混合液显示碱性.

练习册系列答案
相关题目
下列物质中,属于共价化合物的是( )
| A、NH3 |
| B、Na2O |
| C、CaCl2 |
| D、MgO |
在一定条件下将A和B加入密闭容器中发生反应:A(g)+B(s)?2C(g).忽略固体体积,平衡时C的体积分数随温度和压强的变化如下表所示(“-”为未测数据).
下列说法正确的是( )
| 1.0 | 2.0 | 3.0 | |
| 810 | 54.0 | - | a |
| 915 | - | 75.0 | - |
| 1000 | - | b | 83.0 |
| A、△S<0 |
| B、915℃2.0MPa,A的转化率为60% |
| C、a>b |
| D、平衡常数:K(1000℃)<K(810℃) |
以Pt作电极,用电源串联电解分装在两个烧杯里的200mL 0.3mol/L NaCl溶液和300mL 0.2mol/L的CuSO4溶液,过一段时间取出电极,将两杯溶液混合,则对混合溶液的pH判断正确的是( )
| A、小于7 | B、大于7 |
| C、小于或等于7 | D、大于7或等于7 |
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
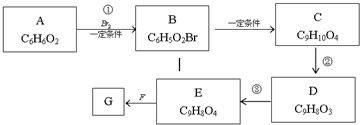



 ,物质E含2个六元环.
,物质E含2个六元环.