题目内容
16.某兴趣小组同学利用如图装置测定铁矿石样品的含量.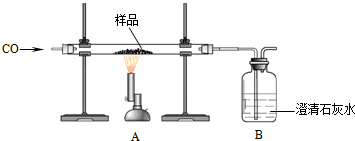
(1)A中反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,B中的实验现象是澄清石灰水变浑浊.
(2)待充分反应后,该小组同学记录的实验数据如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.50g | 反应前55.56g | 反应前281.00g |
| 反应后55.08g | 反应后281.25g |
分析 铁冶炼的一般步骤是:①先通入一氧化碳②再加热③停止加热④继续通一氧化碳直到试管冷却;体现了酒精灯的迟到早退.还要注意反应原理和尾气的处理,注意化学方程式的配平.有关计算问题,可以根据表格提供的数据计算.
解答 解:(1)测定铁矿石样品的含量,一氧化碳高温下加热还原氧化铁,实验的现象是:A中红色变黑色;B中澄清石灰水变浑浊.一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳;二氧化碳和氢氧化钙反应生成碳酸钙和水,Ca(OH)2+CO2=CaCO3↓+H2O,
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe;澄清石灰水变浑浊;
(2)装置B不能将反应产生的CO2全部吸收,不能选用的数据是装置B,
根据表格数据:要用差量法理解:装置A质量减轻的原因是氧化铁样品丢掉了氧.减轻的质量就是样品中氧元素的质量=55.56g-55.08g=0.48g,物质的量n(O)=$\frac{0.48g}{16g/mol}$=0.03mol,
Fe2O3~3O,
1 3
0.01mol 0.03mol
该铁矿石中含有氧化铁的质量分数=$\frac{0.01mol×160g/mol}{2.5g}$×100%=64%,
故答案为:装置B不能将反应产生的CO2全部吸收;64%;
点评 本考点考查了铁的冶炼,是结合课本知识的信息.炼铁的原理是用还原剂一氧化碳把铁从它的氧化物中还原出来,因为一氧化碳有毒,因此要进行尾气处理.本题还考查了实验数据的处理,并对实验进行了评价,是中考考查的重点之一,题目难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
4.用如图所示的简易净水器净化水,其中活性炭的主要作用是( )


| A. | 沉淀 | B. | 吸附 | C. | 蒸馏 | D. | 消毒 |
11.下列实际应用中,利用中和反应反应原理的是( )
①用氢氧化钠溶液洗去石油产品中的残余硫酸;
②用稀氨水涂抹在被蚊虫叮咬处(分泌出蚁酸)止痒;
③施用熟石灰改良酸性土壤;
④用碳酸氢钠治疗胃酸过多.
①用氢氧化钠溶液洗去石油产品中的残余硫酸;
②用稀氨水涂抹在被蚊虫叮咬处(分泌出蚁酸)止痒;
③施用熟石灰改良酸性土壤;
④用碳酸氢钠治疗胃酸过多.
| A. | ①③ | B. | ②③④ | C. | ①②③ | D. | ①②③④ |
1.根据热化学方程式(在101kPa下):S(s)+O2(g)═SO2(g)△H=-297.3kJ•mol-1分析下列说法,其中不正确的是( )
| A. | 该条件下32g S(s)完全燃烧放出的热量为297.23kJ | |
| B. | 反应S(g)+O2(g)═SO2(g)的△H大于-297.3kJ•mol-1 | |
| C. | 反应S(g)+O2(g)═SO2(g)的△H小于-297.3kJ•mol-1 | |
| D. | 形成1 mol SO2(g)中的化学键所释放的总能量大于断裂1 mol S(s)和1mol O2(g)中的化学键所吸收 |
5.工业生产高纯硅涉及的化学方程之一为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,该反应属于( )
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
6.三甲基铝(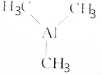 )可用于金属有机化合物气相沉积,下列有关说法正确的是( )
)可用于金属有机化合物气相沉积,下列有关说法正确的是( )
 )可用于金属有机化合物气相沉积,下列有关说法正确的是( )
)可用于金属有机化合物气相沉积,下列有关说法正确的是( )| A. | 三甲基铝的摩尔质量是72 | |
| B. | 14.4g三甲基铝中碳原子数为0.6NA | |
| C. | 0.5mol三甲基铝的质量为36g•mol-1 | |
| D. | 1mol三甲基铝在标准状况下的体积约为22.4L |
 在5-氨基四唑(
在5-氨基四唑(  )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.