题目内容
8. 在5-氨基四唑(
在5-氨基四唑(  )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.(1)Ga与铝同主族,基态Ga原子的电子排布式可表示为[Ar]3d104s24p1;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为N>C>H,其中N原子的杂化类型为sp2、sp3;在1mol5-氨基四唑中含有的σ键的数目为9NA.
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),与N3-互为等电子体的一种分子的化学式为N2O(CO2、CS2等).
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,这种碳氮化钛化合物的化学式为Ti4CN3.
分析 (1)Ga是31号元素,其核外有31个电子,根据构造原理写出其核外电子排布式;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;根据价层电子对互斥理论确定其杂化方式;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)①原子个数相等、价电子数相等的微粒互为等电子体;
②利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式.
解答 解:(1)Ga是31号元素,其核外有31个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s24p1,故答案为:[Ar]3d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
含有两个共价单键和一个孤电子对的N原子其杂化方式是sp2,含有三个共价单键和一个孤电子对的N原子其杂化方式是sp3;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;sp2、sp3;9NA;
(3)①原子个数相等、价电子数相等的微粒互为等电子体,N3-中原子个数是3、价电子数是16,所以其等电子体有N2O、CO2、CS2,
故答案为:N2O(CO2、CS2等);
②该晶胞中碳原子个数=8×$\frac{1}{8}$,N原子个数=6×$\frac{1}{2}$,Ti原子个数=1+12×$\frac{1}{4}$,所以其化学式为Ti4CN3,故答案为:Ti4CN3.
点评 本题考查核外电子排布、电负性、杂化方式、等电子体、化学式的确定等知识点,都属高频考点,会运用价层电子对互斥理论确定杂化方式和利用均摊法确定化学式是解本题的关键,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律;
(2)实验用品:仪器:①烧杯②试管③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等;药品:钠、镁带、铝条、2mol•L-1的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象)1B2F3A4D5C6E(用A-F表示);写出③的离子方程式2Na+2H2O=2Na++2OH-+H2↑;
(4)实验结论:金属性:Na>Mg>Al;非金属性:Cl>S.
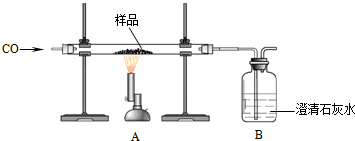
(1)A中反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe,B中的实验现象是澄清石灰水变浑浊.
(2)待充分反应后,该小组同学记录的实验数据如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.50g | 反应前55.56g | 反应前281.00g |
| 反应后55.08g | 反应后281.25g |
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 加入新制的生石灰,再加热蒸馏,可以除去乙醇中的少量水 | |
| D. | Mg(OH)2中混有少量Al(OH)3,加入足量烧碱溶液,充分反应,过滤 |
| A. | 质子数是212 | B. | 中子数是130 | C. | 电子数是194 | D. | 质量数是82 |
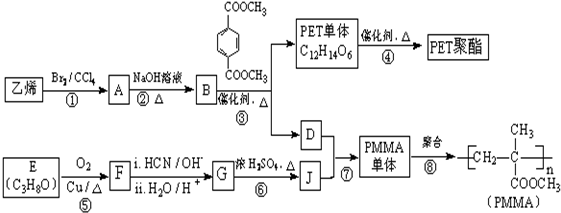
 $→_{H_{2}O/H+}^{i.HCN/OH-}$
$→_{H_{2}O/H+}^{i.HCN/OH-}$ (R、R′代表烃基)
(R、R′代表烃基)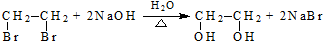
 .
.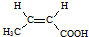 .
.

 .
. 和
和  ,鉴别I和J的试剂为FeCl3或浓溴水.
,鉴别I和J的试剂为FeCl3或浓溴水. 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:
制得,写出K在浓硫酸作用下生成的聚合物的结构简式: .
.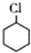 (一氯环己烷)$→_{II}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{II}^{NaOH,乙醇,△}$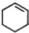 $→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$
$→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$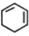
 .
.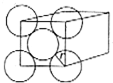 金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求: