题目内容
13.向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应(不考虑CO2的溶解),下列说法不正确的是( )| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a=1.25b时,发生的离子方程式为:5OH-+4CO2═3HCO3-+CO32-+H2O | |
| C. | $\frac{2b}{3}$<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b) | |
| D. | 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a |
分析 向含NaOH和、Na2CO3的混合溶液中通入CO2充分反应,开始反应为:2NaOH+CO2═Na2CO3+H2O,然后发生Na2CO3+CO2+H2O═2NaHCO3,向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应,当a≥2b时,氢氧化钠过量,生成碳酸钠,当a≤$\frac{2}{3}$b时,生成碳酸氢钠,若a:b介于2:3与2:1时生成碳酸钠、碳酸氢钠,以此来解答.
解答 解:A.二氧化碳和碳酸钠反应生成碳酸氢钠,碳酸氢钠和氢氧化钠反应生成碳酸钠和水,所以向含amolNaOH和amolNa2CO3的混合溶液中通入bmolCO2充分反应,开始反应为:2NaOH+CO2═Na2CO3+H2O,当a≥2b时,氢氧化钠过量,发生的离子反应为:2OH-+CO2═CO32-+H2O,故A正确;
B.当a≤$\frac{2}{3}$b时,发生2NaOH+CO2═Na2CO3+H2O、Na2CO3+CO2+H2O═2NaHCO3,当a=1.25b时,假设b=1,则a=1.25mol,发生2NaOH+CO2═Na2CO3+H2O,生成碳酸钠0.625mol,消耗二氧化碳0.625mol,继续发生Na2CO3+CO2+H2O═2NaHCO3,生成碳酸氢钠0.75mol,最终生成碳酸氢钠0.75mol、碳酸钠0.25mol,n(HCO3-):n(CO32-)=3:1,反应为:5OH-+4CO2═3HCO3-+CO32-+H2O,故B正确;
C.若a:b介于2:3与2:1时生成碳酸钠、碳酸氢钠,发生2NaOH+CO2═Na2CO3+H2O,生成碳酸钠0.5amol,消耗二氧化碳0.5amol,继续发生Na2CO3+CO2+H2O═2NaHCO3,生成碳酸氢钠(b-0.5a)mol,最终生成碳酸氢钠(b-0.5a)mol、碳酸钠(a-b)mol,n(HCO3-):n(CO32-)=(a-b):(b-0.5a),故C错误;
D.若反应后溶液中CO32-与OH-物质的量之比为2:1,则氢氧根离子过量,发生2OH-+CO2═CO32-+H2O,若剩余OH-物质的量为1mol,生成CO32-物质的量为2mol,消耗OH-物质的量为4mol,原OH-物质的量为5mol,CO2-物质的量为1mol,5b=a,故D正确;
故选C.
点评 本题考查学生物质间的化学反应以及量的多少之间的关系知识,注意发生的化学反应以及量的应用是关键,题目难度中等.

| A. | 次氯酸的电子式: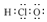 | B. | S2-的结构示意图: | ||
| C. | O-18的原子符号:${\;}_{\;}^{15}$O | D. | CO2分子的结构式:O=C=O |
| A. | 元素非金属性由弱到强的顺序为Z<Y<X | |
| B. | 化合物YZ2中各原子都达到8电子结构 | |
| C. | 这3种元素的氢化物的沸点由高到低的顺序为:Z>Y>X | |
| D. | 其对应的阴离子半径由大到小的顺序为:Z>Y>X |
| A. | 二氧化硅 | B. | 干冰 | C. | 金属铝 | D. | 氧化钠 |
| A. | NO2可由N2与O2反应直接制备 | |
| B. | NO2有毒,但因其易溶于水且与水反应,因此不属于大气污染物 | |
| C. | NO2既有氧化性也有还原性 | |
| D. | NO2为红棕色气体,因此将NO2通入水中,溶液显红棕色 |
| A. | 强碱性溶液中:K+、Cu2+、Cl-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Ba2+、OH-、NO3- | |
| C. | 含有0.1 mol•L-1 Ca2+酸溶液中:Na+、K+、CO32-、Cl- | |
| D. | 室温下,强酸性溶液中:Na+、Fe3+、NO3-、SO42- |
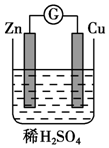 将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题:
将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中请回答下列问题: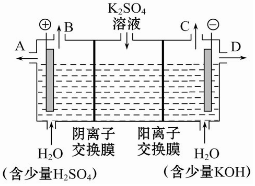 如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.