题目内容
2.H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体.
①该反应的化学方程式为FeS+H2SO4=FeSO4+H2S↑.
②不能用燃烧的方法处理尾气H2S气体的理由是燃烧产生的SO2 也是大气污染物.
(2)用30%FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S═S↓+2FeCl2+2HCl,废吸收液经电解可循环使用.
①该反应中H2S显d(填字母).
a.不稳定性 b.弱酸性 c.氧化性 d.还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是KSCN溶液.
(3)在Fe(OH)3胶体中逐滴加入HI稀溶液,会出现一系列变化:
①先出现红褐色沉淀,原因是:加入电解质,使胶体聚沉;
②随后沉淀溶解,溶液呈黄色,写出此过程反应的离子方程式:Fe(OH)3+3H+=Fe3++3H2O;
③最后溶液颜色加深或黄褐色,用离子方程式表示该过程:2Fe3++2I-=2Fe2++I2.
分析 (1)①实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体,是强酸制弱酸,复分解反应;
②硫化氢是酸性气体,可用碱液吸收,硫化氢燃烧生成有毒的气体,污染大气;
(2)①由反应方程式可知:2FeCl3+H2S=S↓+2FeCl2+2HCl,硫的化合价升高,硫化氢是还原剂;
②KSCN溶液检验铁离子的存在;
(3)①依据胶体聚沉的性质解答;
②氢氧化铁与氢碘酸发生酸碱中和反应;
③三价铁离子具有强的氧化性,能够氧化碘离子.
解答 解:(1)①实验室用硫化亚铁固体与稀硫酸反应来制备H2S气体,是强酸制弱酸的复分解反应,方程式为FeS+H2SO4=FeSO4+H2S↑,
故答案为:FeS+H2SO4=FeSO4+H2S↑;
②硫化氢是酸性气体,可用碱液吸收,不能用燃烧的方法处理尾气H2S气体,是因为硫化氢燃烧生成有毒的气体SO2也是大气污染物,
故答案为:燃烧产生的SO2 也是大气污染物;
(2)①由反应方程式可知:2FeCl3+H2S=S↓+2FeCl2+2HCl,硫的化合价升高,硫化氢是还原剂,故选:d;
②硫氰化钾溶液与铁离子反应,溶液显示红色,可以检验溶液中是否含有铁离子,
故答案为:KSCN溶液;
(3)①碘化氢为可溶性电解质,能够使氢氧化铁胶体发生聚沉,出现红褐色沉淀;
故答案为:加入电解质,使胶体聚沉;
②氢氧化铁与氢碘酸发生酸碱中和反应:Fe(OH)3+3H+═Fe3++3H2O,所以沉淀溶解,溶液呈黄色;
故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③三价铁离子具有强的氧化性,能够氧化碘离子,生成单质碘,反应的离子方程式为:2Fe3++2I-═I2+2Fe2+,所以最后溶液颜色加深或黄褐色;
故答案为:2Fe3++2I-═I2+2Fe2+.
点评 本题考查硫化氢的制法和性质、氢氧化铁胶体的制备和性质,硫化氢中硫是-2价最低价态,具有还原性,注意了解胶体的制备及性质,题目难度不大.


| A. | 用图a所示装置干燥NH3气体 | |
| B. | 用图b所示装置蒸发NaCl溶液得NaCl晶体 | |
| C. | 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 用图d所示装置测量氯气的体积 |
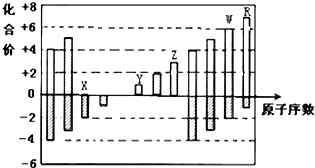
| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| D. | WX3和水反应形成的化合物是离子化合物 |
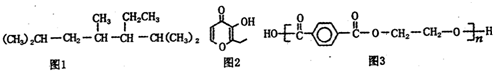
| A. | 按系统命名法命名,图1化合物的名称是2,4,6一三甲基-5-乙基庚烷 | |
| B. | 图2有机物的一种芳香族同分异构体能发生银镜反应 | |
| C. | 图2有机物能使酸性高锰酸钾溶液褪色 | |
| D. | 图3为髙分子化合物,其单体为对苯二甲酸和乙醇 |
①由甲苯制甲基环己烷、由乙烷制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾溶液褪色
③由乙烯制聚乙烯、由丁二烯制聚-1,3-丁二烯
④由苯制硝基苯、由苯制溴苯.
| A. | ②③ | B. | ③④ | C. | ①③ | D. | ①④ |
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
据此判断下列说法正确的是( )
| A. | CH3OH的燃烧热为1452kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H>-571.6kJ/mol | |
| C. | 2CH3OH(l)+O2(g)═2CO2(g)+4H2(g)△H=-880.4kJ/mol | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H=-57.3kJ/mol |
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1 |
| A. | $\frac{a}{A}$(A-N)mol | B. | $\frac{a}{A+2m}$(A-N+m)mol | C. | $\frac{a}{A+2m}$(A-N)mol | D. | $\frac{a}{A+m}$(A-N+m)mol |
| A. | N2 | B. | NO | C. | CH4 | D. | NH3 |