题目内容
9.加入少许下列一种物质,不能使溴水颜色显著变浅的是( )| A. | Mg粉 | B. | KOH溶液 | C. | KI溶液 | D. | CCl4 |
分析 溴与金属单质、碱均发生化学反应,溴水褪色,溴水与四氯化碳发生萃取,而溴水与KI发生反应生成碘,溶液颜色加深,以此来解答.
解答 解:A.Mg与溴水反应生成无色溶液,颜色变浅,故A不选;
B.KOH与溴水反应生成无色溶液,颜色变浅,故B不选;
C.溴水与KI发生反应生成碘,溶液颜色加深,故C选;
D.溴水与四氯化碳发生萃取,使溴水颜色显著变浅,故D不选;
故选C.
点评 本题考查物质性质,为高考常见题型,侧重于学生的分析能力、应用能力的考查,把握物质的性质、发生的反应和现象为解答该类题目的关键,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
20.N2和 H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
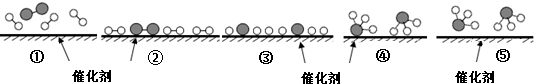
 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
17. 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中正确的是( )| A. | 装置乙的b极要与装置甲的X极连接 | |
| B. | 装置乙中a极的电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 若有机废水中主要含有葡萄糖,则装置甲中M的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | N电极发生还原反应,当N电极消耗56 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
4.下列解释事实的反应方程式正确的是( )
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- |
14.关于石油和石油化工的说法错误的是( )
| A. | 石油大体上是由各种碳氢化合物组成的混合物 | |
| B. | 石油分馏得到的各馏分是由各种碳氢化合物组成的混合物 | |
| C. | 石油裂解和裂化的主要目的都是为了得到重要产品乙烯 | |
| D. | 实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油 |
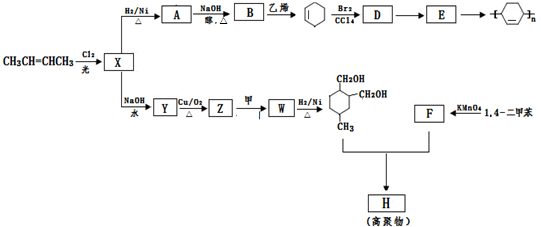
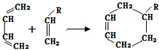 (或写成
(或写成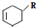 R代表取代基或氢)
R代表取代基或氢)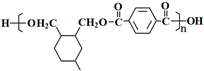 .
.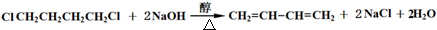 ;
;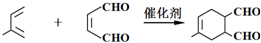 .
.
 ,属于弱电解质的是H2O、Al(OH)3.
,属于弱电解质的是H2O、Al(OH)3.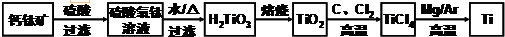
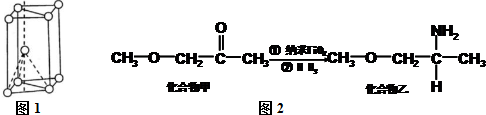
 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).