题目内容
8.使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为2:2:1,则上述三种溶液的体积比是( )| A. | 9:3:1 | B. | 3:2:1 | C. | 6:3:1 | D. | 9:4:1 |
分析 由题意可知完全沉淀,则Cl-+Ag+═AgCl↓,设AgNO3溶液的浓度都是c,则利用n=cV可计算消耗的Ag+的物质的量,再由反应可计算三种溶液的体积比.
解答 解:设AgNO3溶液的浓度都是c,体积分别为2V、2V、V,NaCl、MgCl2、AlCl3溶液的浓度都是c1,设体积分别为x、y、z,完全沉淀时发生反应Cl-+Ag+═AgCl↓,由方程式可知:
c1×x=c×2V,
c1×2×y=c×2V,
c1×3×z=c×V,
解得x:y:z=$\frac{c×2V}{c1}:\frac{c×2V}{c1×2}:\frac{c×V}{c1×3}$=2:1:$\frac{1}{3}$=6:3:1,
故选C.
点评 本题考查学生利用离子反应方程式进行的计算,明确完全沉淀时氯离子和银离子的关系是解答本题的关键,注意解答中未知的量可以利用假设来分析解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.生活离不开化学.下列对生活中各种物质的认识不正确的是( )
| A. | 普通肥皂的主要成分是高级脂肪酸钠盐 | |
| B. | 利用氢化反应将液态植物油转变为固态反式脂肪酸的过程发生的是还原反应 | |
| C. | “皮革奶粉”含有大量有毒物质,不能食用 | |
| D. | 沾有血迹的衣物要用热水和加酶洗衣粉浸泡 |
6.对下列事实的解释正确的是( )
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | 分别用盛满HCl气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同 | |
| C. | 向50 mL 18 mol•L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
3.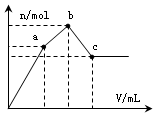 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
 浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
浓度为 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液100mL中,逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点对应的沉淀,其物质的量为0.01mol | |
| B. | b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| C. | 沉淀质量最大值为4.66g | |
| D. | c点加入Ba(OH)2溶液的体积为250 mL |

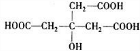 .
.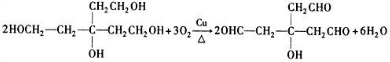 .
.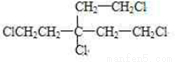 .
.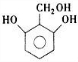 、
、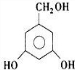 .
.