题目内容
18.A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示,D的相对分子质量与E相差42,请回答下列问题: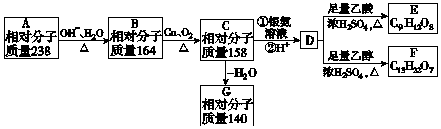
(1)D中含有的官能团是-COOH;D的分子式为C7H10O7.
(2)D的核磁共振氢谱中出现3组峰,请写出D的结构简式:
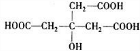 .
.(3)写出B生成C的化学方程式:
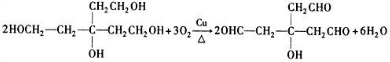 .
.(4)A只含一种官能团,则A的结构简式为
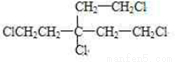 .
.(5)芳香族化合物H与G互为同分异构体,1mol H与足量氢氧化钠溶液反应消耗2mol NaOH,且H的核磁共振氢谱中出现5组峰,峰面积之比为2:2:2:1:1,写出符合条件的H的结构简式:
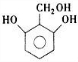 、
、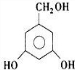 .
.
分析 由转化关系可知,A在NaOH水溶液、加热条件下生成B,B在Cu、氧气加热条件下生成C,故B为醇,则C含有-CHO或羰基,C氧化生成D,D能与乙酸、乙醇反应,故D含有羧基-COOH、羟基-OH,故B中含有不能被氧化的-OH,由B、C的相对分子质量可知,B中能被氧化的-OH数目为(164-158)÷2=3,故B中至少含有4个-OH.由E、F中C原子数目可知,D中-COOH比-OH多2个,由F中氧原子可知D中最多有3个-COOH,故D中含有3个-COOH、1个-OH,故D中含有7个碳原子,C中含有3个-CHO、1个-OH,由转化关系可知B、C、D中碳原子数目相等,都为7个,故C中剩余基团的式量为158-17-29×3-12×(7-3)=6,故C中还含有6个H原子,C的分子式为C7H10O4,C氧化为D,-CHO转化为-COOH,故D为C7H10O7,D分子中不含甲基,依据问题(2)D的核磁共振氢谱图上有3个峰,故D的结构简式为 ,逆推可得C的结构简式为
,逆推可得C的结构简式为 、B为
、B为 ,故G为
,故G为 ,E为
,E为 ,F为
,F为 .A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
.A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为 ,(5)芳香族化合物H与G(
,(5)芳香族化合物H与G( )互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且H的核磁共振氢谱中出现5组峰,峰面积之比为2:2:2:1:1,所有符合条件的H的结构简式为:
)互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且H的核磁共振氢谱中出现5组峰,峰面积之比为2:2:2:1:1,所有符合条件的H的结构简式为: 、
、 ,据此进行分析.
,据此进行分析.
解答 解:由转化关系可知,A在NaOH水溶液、加热条件下生成B,B在Cu、氧气加热条件下生成C,故B为醇,则C含有-CHO或羰基,C氧化生成D,D能与乙酸、乙醇反应,故D含有羧基-COOH、羟基-OH,故B中含有不能被氧化的-OH,由B、C的相对分子质量可知,B中能被氧化的-OH数目为(164-158)÷2=3,故B中至少含有4个-OH.由E、F中C原子数目可知,D中-COOH比-OH多2个,由F中氧原子可知D中最多有3个-COOH,故D中含有3个-COOH、1个-OH,故D中含有7个碳原子,C中含有3个-CHO、1个-OH,由转化关系可知B、C、D中碳原子数目相等,都为7个,故C中剩余基团的式量为158-17-29×3-12×(7-3)=6,故C中还含有6个H原子,C的分子式为C7H10O4,C氧化为D,-CHO转化为-COOH,故D为C7H10O7,据此进行分析,
(1)D为C7H10O7,C氧化为D,故将-CHO转化为-COOH,故答案为:-COOH;C7H10O7;
(2)D的分子式为C7H10O7且D的核磁共振氢谱图上有3个峰,故D的结构简式为 ,故答案为:
,故答案为: ;
;
(3)D的结构简式为 ,逆推可得C的结构简式为
,逆推可得C的结构简式为 ,B为
,B为 ,故B生成C的化学方程式为:
,故B生成C的化学方程式为: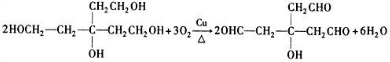 ,
,
故答案为: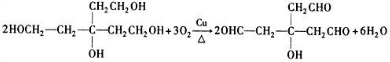 ;
;
(4)C为 ,故G为
,故G为 ,E为
,E为 ,F为
,F为 ,则A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
,则A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为 ,
,
故答案为: ;
;
(5)芳香族化合物H与G( )互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且H的核磁共振氢谱中出现5组峰,峰面积之比为2:2:2:1:1,所有符合条件的H的结构简式为:
)互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且H的核磁共振氢谱中出现5组峰,峰面积之比为2:2:2:1:1,所有符合条件的H的结构简式为: 、
、 ,故答案为:
,故答案为: 、
、 .
.
点评 本题考查有机物推断,需要学生充分利用分子式、相对原子质量综合分析各物质含有的官能团、C原子数目等进行推断,是对学生综合能力的考查,难度较大.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 9:3:1 | B. | 3:2:1 | C. | 6:3:1 | D. | 9:4:1 |
| A. | 千锤万凿出深山 | B. | 雪融山顶响流泉 | C. | 吹尽狂沙始到金 | D. | 蜡炬成灰泪始干 |
 (1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.(2)基态磷原子核外有15种运动状态不同的电子.
(3)CO的结构可表示为
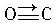 与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3 401 |
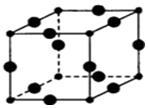
(5)Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示)
| 选项 | a | b | c |  |
| A | Al | Al2O3 | Al (OH)3 | |
| B | SiO2 | Na2SiO3 | H2SiO3 | |
| C | AlCl3 | Na[Al(OH)4] | Al(OH)3 | |
| D | CaO | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
| X | Y | |
| Z | W |
| A. | X、Y 均能形成不止一种氢化物 | |
| B. | YO 2是一种有毒气体,属于酸性氧化物 | |
| C. | Y 的最简单氢化物比 Z 的稳定性更强 | |
| D. | XW2中各原子最外层均达到 8e-稳定结构 |

 .
. $\stackrel{P_{2}O_{5}}{→}$
$\stackrel{P_{2}O_{5}}{→}$ .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$ 