题目内容
9.原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:(1)A、C、D形成的化合物的电子式
 ,所含化学键的类型离子键和极性共价键;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O用电子式表示BA3的形成过程3H•+
,所含化学键的类型离子键和极性共价键;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O用电子式表示BA3的形成过程3H•+ →
→ ,A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H,C2-的离子结构示意图
,A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H,C2-的离子结构示意图 ,A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的表示方法31H或T
,A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的表示方法31H或T(2)已知B2A4与BA3具有相似的性质,B2A4通过炽热黑色的粉末,黑色的粉末变为红色,且产物对大气无污染,其化学反应方程式N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O.3.2g的B2A4全部参加反应,转移电子的数目为0.4NA还原剂是N2H4
(3)元素F与B同周期,是形成有机化合物必需的元素.在298K下,E,F的单质各1mol完全燃烧,分别放出热量akJ和bkJ.又知一定条件下,E的单质能将F从它的最高价氧化物中置换出来,若此置换反应生成3molF的单质(注:题中所设单质均为最稳定单质)则该反应在298K下△H=(3b-4a)kJ/mol或-(4a-3b)kJ/mol;F在周期表中的位置第二周期第ⅣA族.
分析 原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,则A为H元素;C原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;B的单质分子中有三对共用电子,原子序数小于氧,则B为N元素;A、D同主族,D的原子序数大于氧,故D为Na;E原子电子数比C原子电子数多5个,则E原子核外电子数为13,故E为Al,以此解答该题.
解答 解:原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,则A为H元素;C原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;B的单质分子中有三对共用电子,原子序数小于氧,则B为N元素;A、D同主族,D的原子序数大于氧,故D为Na;E原子电子数比C原子电子数多5个,则E原子核外电子数为13,故E为Al,
(1)A、C、D形成的化合物为NaOH,电子式为 ,含有离子键和极性共价键,
,含有离子键和极性共价键,
D、E的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
氨气为共价化合物,分子中存在3个氮氢键,其形成过程为:3H•+ →
→ ,
,
A、C形成的化合物中,C的质量分数最高的化合物为H2O2,其结构式为:H-O-O-H;
氧离子核外有10电子,结构示意图为 ;
;
A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是:31H或T,
故答案为: ;离子键和极性共价键;Al(OH)3+OH-=AlO2-+2H2O; 3H•+
;离子键和极性共价键;Al(OH)3+OH-=AlO2-+2H2O; 3H•+ →
→ ;H-O-O-H;
;H-O-O-H; ;31H或T;
;31H或T;
(2)N2H4与NH3具有相似的性质,N2H4通过炽热黑色的粉末,黑色的粉末变为红色,且产物对大气无污染,应是与CuO反应生成氮气、Cu与水,其化学反应方程式为:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O,3.2g的N2H4的物质的量为$\frac{3.2g}{32g/mol}$=0.1mol,反应中N元素化合价由-2升高为0价,全部参加反应,转移电子的数目为 0.1mol×2×2×NAmol-1=0.4NA,反应中N2H4为还原剂,
故答案为:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O; 0.4NA;N2H4;
(3)元素F与B同周期,是形成有机化合物必需的元素,为C元素,位于周期表第二周期第ⅣA族,在298K下,E,F的单质各1mol完全燃烧,分别放出热量akJ和bkJ.可知生成2molAl2O3放出4akJ热量,生成3molCO2放出3bkJ热量,E的单质能将F从它的最高价氧化物中置换出来,若此置换反应生成3molF的单质,反应的方程式为4Al+3CO2=2Al2O3+3C,反应放出的热量为(4a-3b)kJ,
则热化学方程式为4Al(s)+3CO2(g)=2Al2O3(s)+3C(s)△H=(3b-4a)kJ/mol或-(4a-3b)kJ/mol
故答案为:(3b-4a)kJ/mol或-(4a-3b)kJ/mol;第二周期第ⅣA族.
点评 本题考查结构性质位置关系应用,为高考常见题型,侧重学生的分析能力以及化学用语的考查,明确元素种类是解题关键,有利于基础知识的巩固.

| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
| A. | 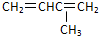 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. | CH3CH(OH)CH2CH32-羟基丁烷 | ||
| C. |  顺-2-丁烯 顺-2-丁烯 | D. | CH3CH(NH2)CH2COOH 3-氨基丁酸 |
| A. | 对甲基苯酚( )属于芳香烃 )属于芳香烃 | B. |  TNT TNT | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. |  3-甲基-1-丁烯 3-甲基-1-丁烯 |
| A. | 在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 由 C(s,石墨)→C(s,金刚石)-1.9kJ可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+57.3kJ,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)→2H2O(l)+285.8kJ |
| A. | CH3CH2CH2OH+CuO $\stackrel{△}{→}$ CH3CH2CHO+H2O+Cu | |
| B. | CH3-C≡CH+HCl $\stackrel{催化剂}{→}$ CH3CCl=CH2 | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{醇}$ CH3CH=CH2+NaCl+H2O | |
| D. | CH3CH2CH2Cl+NaOH$\stackrel{△}{→}$ CH3CH2CH2OH+NaCl |