题目内容
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向 5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
①5min内该反应的平均速率υ(NO)= ;在T℃时,该反应的平衡常数K= .
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号).
a.混合气体的密度
b.混合气体的压强
c.正反应速率
d.单位时间内,N2和NO的消耗量之比
③平衡时氮气的转化率为 .
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,反应:
2NO(g)+2CO(g)?2CO2(g)+N2(g)中NO的浓度c(NO) 随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.该反应的△H 0(填“>”或“<”).
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)?2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向 5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol.
①5min内该反应的平均速率υ(NO)=
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是
a.混合气体的密度
b.混合气体的压强
c.正反应速率
d.单位时间内,N2和NO的消耗量之比
③平衡时氮气的转化率为
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图表示在其他条件不变时,反应:
2NO(g)+2CO(g)?2CO2(g)+N2(g)中NO的浓度c(NO) 随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.该反应的△H

考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)①利用三段法“开始 变化 平衡”列出各组分数据,代入化学反应速率和化学平衡常数表达式计算;
②a.混合气体的总质量不变,容器的体积不变,据此判断;
b.混合气体总的物质的量不变,容器体积不变,据此判断;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大;
③平衡时氮气的转化率=
×100%;
(2)根据图象中先拐先平速率大,则温度高,结合温度对平衡的影响分析.
②a.混合气体的总质量不变,容器的体积不变,据此判断;
b.混合气体总的物质的量不变,容器体积不变,据此判断;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大;
③平衡时氮气的转化率=
| 转化的氮气的物质的量 |
| 开始时氮气的物质的量 |
(2)根据图象中先拐先平速率大,则温度高,结合温度对平衡的影响分析.
解答:
解:(1)①T℃时,向 5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol,
由题中所给数据可知:
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.3 1.5 0
转化浓度(mol?L-1)0.5 0.5 1.0
平衡浓度(mol?L-1)0.8 1.0 1.0
则υ(NO)=
=0.2mol/(L?min),K=
=
=1.25,
故答案为:0.2mol/(L?min);1.25;
②a.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故a不符合;
b.混合气体总的物质的量不变,容器体积不变,混合气体的压强不变,故b不符合;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低,故c符合;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大,单位时间内,N2和NO的消耗量之比减小,故d符合;
故答案为:cd;
③平衡时氮气的转化率=
×100%=
×100%=38.5%;
故答案为:38.5%;
(2)根据图象中先拐先平速率大,可知T2时先达到平衡状态,则温度T2大于T1,温度越高NO的浓度的浓度越大,则升高温度平衡逆向移动,所以正方向为放热反应,即△H<0;
故答案为:<.
由题中所给数据可知:
N2(g)+O2(g)?2NO(g)
起始浓度(mol?L-1)1.3 1.5 0
转化浓度(mol?L-1)0.5 0.5 1.0
平衡浓度(mol?L-1)0.8 1.0 1.0
则υ(NO)=
| 1.0mol/L |
| 5min |
| c2(NO) |
| c(N2)c(O2) |
| 1.02 |
| 0.8×1.0 |
故答案为:0.2mol/(L?min);1.25;
②a.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故a不符合;
b.混合气体总的物质的量不变,容器体积不变,混合气体的压强不变,故b不符合;
c.随反应进行,反应物浓度降低,正反应速率逐渐降低,故c符合;
d.随反应进行,反应物浓度降低,正反应速率逐渐降低,生成物的浓度增大,逆反应速率增大,故单位时间内,N2的消耗量减小,NO的消耗量增大,单位时间内,N2和NO的消耗量之比减小,故d符合;
故答案为:cd;
③平衡时氮气的转化率=
| 转化的氮气的物质的量 |
| 开始时氮气的物质的量 |
| 0.5 |
| 1.3 |
故答案为:38.5%;
(2)根据图象中先拐先平速率大,可知T2时先达到平衡状态,则温度T2大于T1,温度越高NO的浓度的浓度越大,则升高温度平衡逆向移动,所以正方向为放热反应,即△H<0;
故答案为:<.
点评:本题涉及反应速率和化学平衡的综合应用,侧重于考查学生的计算能力和对化学平衡知识的综合应用能力,综合性强,难度中等,注意三段式是解平衡题常用的方法.

练习册系列答案
相关题目
有关化学用语正确的是( )
| A、乙烯的最简式C2H4 |
| B、乙醇的结构简式C2H6O |
C、四氯化碳的电子式  |
| D、乙酸的分子式C2H4O2 |

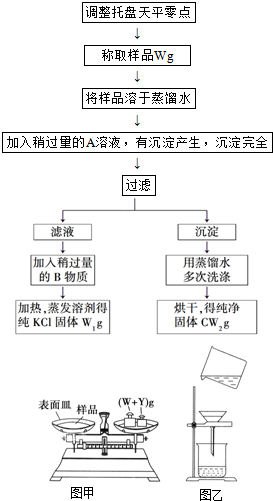 实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.
实验室里有一瓶KCl和CaCl2的固体混合物,通过下述实验方法可以确定该混合物中KCl和CaCl2的质量比,也可得到纯净的氯化钾.根据实验步骤填写下列空白.