题目内容
已知下列热化学方程式:S(s)+O2(g)=SO2(g)△H1=-296kJ/mol;2SO2(g)+O2(g)?2SO3(g)△H=-198kJ/mol;
(1)请写出固体硫单质生成SO3(g)的热化学方程式 ;△S 0(填“>”或“<”或“=”).
(2)向某恒温恒容的体积为2L的容器中加入2mol二氧化硫气体和1mol氧气,达到平衡后,放出的热量为178.2kJ.
①请问该温度下,2SO2(g)+O2(g)?2SO3(g)的平衡常数为 ;
②若改为加入1molSO2、0.5molO2和1molSO3,则放出的热为 kJ;
③如若在一体积相同,但采取了隔热措施的恒容容器中进行,则放出的热 178.2kJ(填“>”或“<”或“=”,下同);如若在一体积相同,但为恒温恒压容器中进行,则放出的热 178.2kJ;若向体积为1L的恒温恒容的容器中通入2molSO2和1molO2,则达到平衡放的热 178.2kJ.
(1)请写出固体硫单质生成SO3(g)的热化学方程式
(2)向某恒温恒容的体积为2L的容器中加入2mol二氧化硫气体和1mol氧气,达到平衡后,放出的热量为178.2kJ.
①请问该温度下,2SO2(g)+O2(g)?2SO3(g)的平衡常数为
②若改为加入1molSO2、0.5molO2和1molSO3,则放出的热为
③如若在一体积相同,但采取了隔热措施的恒容容器中进行,则放出的热
考点:有关反应热的计算,用盖斯定律进行有关反应热的计算,化学平衡常数的含义
专题:
分析:(1)已知S(s)+O2(g)=SO2(g)△H1=-296kJ/mol;2SO2(g)+O2(g)?2SO3(g)△H=-198kJ/mol;根据二者结合盖斯定律构建目标方程式求出反应热,然后写出热化学方程式;根据气体的物质的量变化判断熵变;
(2)①根据反应放出的热量求出参加反应的二氧化硫,然后利用三段式求出平衡时的浓度,再求出平衡常数;
②改为加入1molSO2、0.5molO2和1molSO3,若全部转化为反应物,则与原来的加入量相同,是等效平衡,则平衡时各物质的量与原平衡相同,求出转化的二氧化硫的物质的量,再根据物质的量之比等于热量比求出反应热;
③温度升高,平衡逆向移动,则参加反应的二氧化硫的物质的量减少;恒温恒压容器中进行,反应后物质的量减小,则平衡正移;缩小体积,压强增大,平衡正向移动.
(2)①根据反应放出的热量求出参加反应的二氧化硫,然后利用三段式求出平衡时的浓度,再求出平衡常数;
②改为加入1molSO2、0.5molO2和1molSO3,若全部转化为反应物,则与原来的加入量相同,是等效平衡,则平衡时各物质的量与原平衡相同,求出转化的二氧化硫的物质的量,再根据物质的量之比等于热量比求出反应热;
③温度升高,平衡逆向移动,则参加反应的二氧化硫的物质的量减少;恒温恒压容器中进行,反应后物质的量减小,则平衡正移;缩小体积,压强增大,平衡正向移动.
解答:
解:(1)已知S(s)+O2(g)=SO2(g)△H1=-296kJ/mol ①;
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ/mol ②;
根据盖斯定律:①×2+②得2S(s)+3O2(g)=2SO3(g)△H=(-296kJ/mol)×2+(-198kJ/mol)=-790kJ/mol;
该反应是气体物质的量减少的反应,则熵减小,即△<0;
故答案为:2S(s)+3O2(g)=2SO3(g)△H=-790kJ/mol;<;
(2)①已知2SO2(g)+O2(g)?2SO3(g)△H=-198kJ/mol,向某恒温恒容的体积为2L的容器中加入2mol二氧化硫气体和1mol氧气,达到平衡后,放出的热量为178.2kJ,则参加反应的二氧化硫n(SO2)=
=1.8mol,
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 1
反应(mol):1.8 0.9 1.8
平衡(mol):0.2 0.1 1.8
则平衡时浓度:c(SO2)=0.1mol/L,c(O2)=0.05mol/L,c(SO3)=0.9mol/L,
则K=
=1620;
故答案为:1620;
②改为加入1molSO2、0.5molO2和1molSO3,若全部转化为反应物,则与原来的加入量相同,是等效平衡,则平衡时各物质的量与原平衡相同,
设转化的二氧化硫为xmol,
2SO2(g)+O2(g)?2SO3(g)
开始(mol):1 0.5 1
反应(mol):x 0.5x x
平衡(mol):1-x 0.5-0.5x 1+x
则1-x=0.2,所以x=0.8mol,则Q=
=79.2kJ;
故答案为:79.2;
③如若在一体积相同,但采取了隔热措施的恒容容器中进行,该反应为放热反应,则温度升高,平衡逆向移动,所以参加反应的二氧化硫的物质的量减少,则放出的热量减小,即<178.2kJ;恒温恒压容器中进行,反应后物质的量减小,则平衡正移,参加反应的二氧化硫的物质的量增大,所以放出的热量增多,则>178.2kJ;若向体积为1L的恒温恒容的容器中通入2molSO2和1molO2,则容器的体积减小,压强增大,平衡正向移动,则参加反应的物质的增多,所以放出的热量增多,即>178.2kJ.
故答案为:<;>;>.
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ/mol ②;
根据盖斯定律:①×2+②得2S(s)+3O2(g)=2SO3(g)△H=(-296kJ/mol)×2+(-198kJ/mol)=-790kJ/mol;
该反应是气体物质的量减少的反应,则熵减小,即△<0;
故答案为:2S(s)+3O2(g)=2SO3(g)△H=-790kJ/mol;<;
(2)①已知2SO2(g)+O2(g)?2SO3(g)△H=-198kJ/mol,向某恒温恒容的体积为2L的容器中加入2mol二氧化硫气体和1mol氧气,达到平衡后,放出的热量为178.2kJ,则参加反应的二氧化硫n(SO2)=
| 2×178.2 |
| 198 |
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 1
反应(mol):1.8 0.9 1.8
平衡(mol):0.2 0.1 1.8
则平衡时浓度:c(SO2)=0.1mol/L,c(O2)=0.05mol/L,c(SO3)=0.9mol/L,
则K=
| 0.92 |
| 0.12×0.05 |
故答案为:1620;
②改为加入1molSO2、0.5molO2和1molSO3,若全部转化为反应物,则与原来的加入量相同,是等效平衡,则平衡时各物质的量与原平衡相同,
设转化的二氧化硫为xmol,
2SO2(g)+O2(g)?2SO3(g)
开始(mol):1 0.5 1
反应(mol):x 0.5x x
平衡(mol):1-x 0.5-0.5x 1+x
则1-x=0.2,所以x=0.8mol,则Q=
| 198×0.8 |
| 2 |
故答案为:79.2;
③如若在一体积相同,但采取了隔热措施的恒容容器中进行,该反应为放热反应,则温度升高,平衡逆向移动,所以参加反应的二氧化硫的物质的量减少,则放出的热量减小,即<178.2kJ;恒温恒压容器中进行,反应后物质的量减小,则平衡正移,参加反应的二氧化硫的物质的量增大,所以放出的热量增多,则>178.2kJ;若向体积为1L的恒温恒容的容器中通入2molSO2和1molO2,则容器的体积减小,压强增大,平衡正向移动,则参加反应的物质的增多,所以放出的热量增多,即>178.2kJ.
故答案为:<;>;>.
点评:本题考查了盖斯定律的应用、化学平衡移动的有关计算,题目难度中等,侧重于盖斯定律的应用、平衡常数的计算、平衡移动、影响平衡的因素等的考查.

练习册系列答案
相关题目
进行化学实验必须注意安全,下列说法不正确的是( )
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、从煤油中取用金属钠必需用镊子,不能用手触摸 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
下列离子方程式中,正确的是( )
| A、向FeBr2溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全2Ba2++4OH-+Al3++2SO42-+NH4+═2BaSO4↓+Al(OH)3↓+NH3.H2O |
| C、向Mg(HCO3)2溶液中加入过量的 NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
| D、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+H2O |
目前国家仍允许在面粉中添加过氧化苯甲酰来使面粉增白,但它的安全性已引起公众质疑.已知过氧化苯甲酰能发生如下反应:
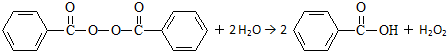
下列叙述不正确的是( )
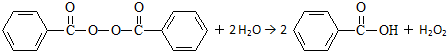
下列叙述不正确的是( )
| A、并非在食品中添加化学物质都对人体有害 |
| B、过氧化苯甲酰能使面粉增白的原因是它与水反应生成的H2O2具有漂白性 |
| C、苯甲酸的同分异构体中,既属于醛又属于酚的物质有4种 |
| D、甲苯经两步取代反应和两步催化氧化反应可转化为苯甲酸 |
中药狼把草的成分之一M具有消炎杀菌作用,M的结构如下所示:下列叙述正确的是( )


| A、M的相对分子质量是180 |
| B、1 mol M最多能与5 mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、1 mol M与足量NaHCO3反应能生成2 mol CO2 |