题目内容
某化学兴趣小组欲测定某品牌味精中氯化钠的含量.该小组的实验步骤如下:
①称取该味精样品10.0g放入烧杯中,并加适量蒸馏水完全溶解;
②加入过量的用硝酸酸化的硝酸银溶液(假定只有NaCl与AgNO3溶液反应).
③过滤;
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得其质量为4.31g;
请回答下列问题:
(1)上述实验步骤③操作中所用到的玻璃仪器有 .
(2)若此品牌味精包装袋上标注:“谷氨酸钠含量≥80.0%,氯化钠含量≤20.0%”;(假设样品中不含其它杂质).通过上述实验结果,可计算出样品中氯化钠的质量分数为 ,所以该样品 (填“合格”或“不合格”).
(3)检验上述实验步骤④所得沉淀是否洗净的方法是:取最后一次洗涤液少量, .
①称取该味精样品10.0g放入烧杯中,并加适量蒸馏水完全溶解;
②加入过量的用硝酸酸化的硝酸银溶液(假定只有NaCl与AgNO3溶液反应).
③过滤;
④用蒸馏水洗涤沉淀2~3次;
⑤将沉淀烘干、称量,测得其质量为4.31g;
请回答下列问题:
(1)上述实验步骤③操作中所用到的玻璃仪器有
(2)若此品牌味精包装袋上标注:“谷氨酸钠含量≥80.0%,氯化钠含量≤20.0%”;(假设样品中不含其它杂质).通过上述实验结果,可计算出样品中氯化钠的质量分数为
(3)检验上述实验步骤④所得沉淀是否洗净的方法是:取最后一次洗涤液少量,
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)依据上述实验步骤③操作为过滤选择使用的玻璃仪器;
(2)依据⑤将沉淀烘干、称量,测得其质量为4.31g,沉淀为AgCl,结合氯元素守恒计算反应的氯化钠质量得到氯化钠质量分数,和题干条件比较判断是否合格;
(3)检验上述实验步骤④所得沉淀是否洗净的方法是检验洗涤液中是否含有银离子,取最后一次洗涤液少量,加入氯化钠溶液,若生成白色沉淀证明未洗涤干净,若无沉淀生成证明洗涤干净.
(2)依据⑤将沉淀烘干、称量,测得其质量为4.31g,沉淀为AgCl,结合氯元素守恒计算反应的氯化钠质量得到氯化钠质量分数,和题干条件比较判断是否合格;
(3)检验上述实验步骤④所得沉淀是否洗净的方法是检验洗涤液中是否含有银离子,取最后一次洗涤液少量,加入氯化钠溶液,若生成白色沉淀证明未洗涤干净,若无沉淀生成证明洗涤干净.
解答:
解:(1)步骤③操作是过滤,过滤操作用到的仪器主要有漏斗(滤纸)、烧杯、玻璃棒、铁架台(铁圈);
故答案为:漏斗(滤纸)、烧杯、玻璃棒;
(2)设生成4.31g氯化银需要参加反应的氯化钠的质量为X则:
AgNO3+NaCl═AgCl↓+NaNO3
58.5 143.5
X 4.31g
=
解得X=1.757g;
NaCl含量为
×100%=17.57%,
此样品是符合产品标示的质量分数;
故答案为:17.57%;合格;
(3)检验上述实验步骤④所得沉淀是否洗净的方法是检验洗涤液中是否含有银离子,取最后一次洗涤液少量,加入氯化钠溶液,若生成白色沉淀证明未洗涤干净,若无沉淀生成证明洗涤干净;
故答案为:加入氯化钠溶液,若生成白色沉淀证明未洗涤干净,若无沉淀生成证明洗涤干净.
故答案为:漏斗(滤纸)、烧杯、玻璃棒;
(2)设生成4.31g氯化银需要参加反应的氯化钠的质量为X则:
AgNO3+NaCl═AgCl↓+NaNO3
58.5 143.5
X 4.31g
| 58.5 |
| X |
| 143.5 |
| 4.31 |
解得X=1.757g;
NaCl含量为
| 1.757g |
| 10.0g |
此样品是符合产品标示的质量分数;
故答案为:17.57%;合格;
(3)检验上述实验步骤④所得沉淀是否洗净的方法是检验洗涤液中是否含有银离子,取最后一次洗涤液少量,加入氯化钠溶液,若生成白色沉淀证明未洗涤干净,若无沉淀生成证明洗涤干净;
故答案为:加入氯化钠溶液,若生成白色沉淀证明未洗涤干净,若无沉淀生成证明洗涤干净.
点评:本题考查了物质组成的分析和实验过程分析判断,主要是实验过程分析应用和计算分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列判断正确的是( )
| A、离子键被破坏的变化一定是化学变化 |
| B、含有金属阳离子的晶体中一定有阴离子 |
| C、分子晶体中分子间作用力越大,分子越稳定 |
| D、NaCl熔化时离子键被破坏,冰熔化时分子中共价键没有断裂 |
下列离子方程式中正确的是( )
| A、NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O |
| C、高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛:6MnO4-+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH-+10H2O |
| D、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |

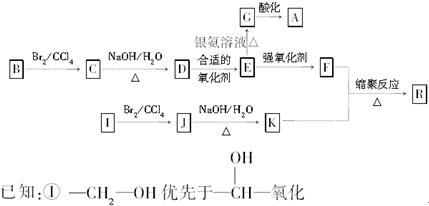
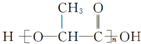 ,有关W的信息如下,其中B能使溴水褪色,C是一个六元状化合物,据此回答下列问题.
,有关W的信息如下,其中B能使溴水褪色,C是一个六元状化合物,据此回答下列问题.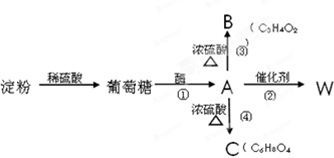
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.据图回答下列问题: