��Ŀ����
6�����л��ܼ�����mmolPCl5��mmolNH4Cl�����ط�����ȫ��Ӧ������4mmolHCl��ͬʱ�õ�һ�ְ�ɫ����R��R���۵�Ϊ113�棬�ڼ�ѹ��50�漴�����������R�������ܶ�Ϊ����ɱ�״����15.54g•L-1���Իش���1��ͨ�������Ƶ�R�Ļ�ѧʽ��
��2�����ӽṹ�ⶨ������R����Ϊ��״����ͬ��Ԫ�ص�ԭ����R�����л��ϼ���ͬ���õ�����-����˫����=���ѷ������ԭ����������д��R���ӵĽṹʽ��
���� ����������ԭ���غ㣬��Ӧ���Ա�ʾΪ��m PCl5+m NH4Cl=4m HCl+��PNCl2��m������M=��Vm����R�����ԭ���������ټ���m��ֵ��ȷ��R�Ļ�ѧʽ�����R����Ϊ��״��ͬ��Ԫ�ص�ԭ����R�����л��ϼ���ͬ��ȷ��R�Ľṹ��ʽ��
��� �⣺��1������������ԭ���غ㣬��Ӧ���Ա�ʾΪ��m PCl5+m NH4Cl=4m HCl+��PNCl2��m��M��R��=15.54g•L-1��22.4L•mol-1=348g•mol-1����m=$\frac{348}{116}$=3����R�Ļ�ѧʽΪ P3N3Cl6��
��R�Ļ�ѧʽΪ P3N3Cl6��
��2��R����Ϊ��״����ͬ��Ԫ�ص�ԭ����R�����л��ϼ���ͬ��R�ĽṹʽΪ ��
��
��R�Ľṹ��Ϊ ��
��
���� ���⿼�������ƶϣ����ڼ������ƶϣ��ؼ��Ǹ���ԭ���غ�ȷ��R�������ԭ����Ŀ֮�ȣ���2���нṹ��ʽ��ȷ��Ϊ�ѵ㡢�״��㣮

��ϰ��ϵ�д�
�����Ŀ
16��25��ʱ������������Һ�У���ˮ�������ɵ�������Ũ��֮�Ȣ٣��ڣ��ۣ����ǣ�������
��1mol•L-1�����ᡡ��0.1mol•L-1������ ��0.01mol•L-1��NaOH��Һ����1mol•L-1��NaOH��Һ��
��1mol•L-1�����ᡡ��0.1mol•L-1������ ��0.01mol•L-1��NaOH��Һ����1mol•L-1��NaOH��Һ��
| A�� | 1��10��100��1 | B�� | 1��10-1��10-12��10-14 | ||
| C�� | 14��13��12��14 | D�� | 14��13��2��1 |
14��500�������£��ں����ܱ������У�����1molNO2��������ƽ��2NO2��g��?N2O4��g����ƽ������������ٳ���1molNO2������˵����ȷ�ģ�������
| A�� | ƽ��������Ӧ�����ƶ����淴Ӧ���ʼ�С | |
| B�� | ƽ�ⳣ��K���� | |
| C�� | NO2��ת���ʱ�� | |
| D�� | ������������ɫ�ȱ�����dz������ԭ����Ҫdz |
1�������йؽ�����ʴ�������˵����ȷ���ǣ�������
| A�� | �ں����������п�鱣����Dz��ܸ�ʴ�Dz������������������������� | |
| B�� | ����������Ʒ�ĶƲ�����ʱ���Ʋ����ܶ�����Ʒ�𱣻����� | |
| C�� | �����������ڿ�������绯ѧ��ʴ�����䰵 | |
| D�� | ������ʴ�ĵ绯ѧ��ʴ����������ԭ���ԭ������ԭ���ԭ���������ڽ������� |
11���±��Dz�ͬ�¶���ˮ�����ӻ�������
�Իش��������⣺
��1��T2��ʱ����pH=11�Ŀ�������ҺV1L��pH=1��ϡ����V2L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=2����V1��V2=9��11������Һ�и������ӵ�Ũ���ɴ�С��˳����c��Na+����c��SO42-����c��H+����c��OH-������
��2��25��ʱ����0.01mol/LNaOH��Һ�ζ�0.02mol/L �����ᣬ�кͺ������ˮϡ�͵�5mL�����ζ�ʱ�յ��ж������ٶ����1��NaOH��Һ���ټ�1��NaOH��Һ����1��Ϊ0.05mL������ٺ͢���Һ��c��OH-��֮����106��1��
��3��25��ʱ��0.1mol/L��NaHCO3��Һ��pHΪ8��ͬŨ�ȵ�NaAlO2��Һ��pHΪ11����������Һ�������ϣ����ܷ����������ɫ����������Ҫԭ���ǣ������ӷ���ʽ��ʾ��HCO3-+AlO2-+H2O=Al��OH��3��+CO32-��
��4����֪25��ʱ��
�÷ϵ�ص�пƤ�Ʊ�ZnSO4•7H2O�Ĺ����У���ȥ���������������䷽���ǣ���ϡ�����H2O2�ܽ⣮���Ӽ����pHΪ2.7ʱ�����պ���ȫ������п��ʼ����������Ũ��С��1��10-5mol/Lʱ��������Ϊ�����ӳ�����ȫ���ٶ�Zn2+Ũ��Ϊ0.1mol/L�������������̲���H2O2�����ԭ����Zn2+��Fe2+���벻����Fe��OH��2��Zn��OH��2��Ksp�������lg2=0.3 lg3=0.48��
| �¶�/�� | 25 | T2 |
| ˮ�����ӻ����� | 1��10-14 | 1��10-12 |
��1��T2��ʱ����pH=11�Ŀ�������ҺV1L��pH=1��ϡ����V2L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=2����V1��V2=9��11������Һ�и������ӵ�Ũ���ɴ�С��˳����c��Na+����c��SO42-����c��H+����c��OH-������
��2��25��ʱ����0.01mol/LNaOH��Һ�ζ�0.02mol/L �����ᣬ�кͺ������ˮϡ�͵�5mL�����ζ�ʱ�յ��ж������ٶ����1��NaOH��Һ���ټ�1��NaOH��Һ����1��Ϊ0.05mL������ٺ͢���Һ��c��OH-��֮����106��1��
��3��25��ʱ��0.1mol/L��NaHCO3��Һ��pHΪ8��ͬŨ�ȵ�NaAlO2��Һ��pHΪ11����������Һ�������ϣ����ܷ����������ɫ����������Ҫԭ���ǣ������ӷ���ʽ��ʾ��HCO3-+AlO2-+H2O=Al��OH��3��+CO32-��
��4����֪25��ʱ��
| ������ | Fe��OH��2 | Fe��OH��3 | Zn��OH��2 |
| Ksp | 8.0��10-16 | 8.0��10-38 | 1.0��10-17 |
18���������������ڵ��ۡ��۵����ʡ�����֬����ϡ������·ֱ����ˮ�⣬����������ֻ��һ�ֵ��ǣ�������
| A�� | �ٺ͢� | B�� | ֻ�Т� | C�� | �ڢۺ͢� | D�� | ֻ�Т� |
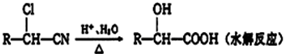
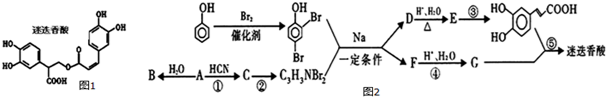
 $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$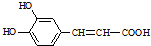 +H2O
+H2O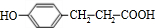 ��
�� �ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��
�ĺϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��

 ��D��E�ķ�Ӧ����Ϊȡ����Ӧ��ˮ�ⷴӦ��
��D��E�ķ�Ӧ����Ϊȡ����Ӧ��ˮ�ⷴӦ�� ��
��  �������10��ԭ�ӹ�ƽ�棬
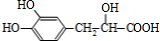
�������10��ԭ�ӹ�ƽ�棬 �������۷�Ӧ�����л���Ľṹ��ʽΪ
�������۷�Ӧ�����л���Ľṹ��ʽΪ ��
�� ��д�ṹ��ʽ����
��д�ṹ��ʽ����