题目内容
19.有一包白色固体粉末,可能由硫酸钠、硝酸钾、硝酸铵、碳酸钙、氯化钡、硫酸铜中的一种或几种组成,做实验得以下结果:(1)将此固体粉末加到水中,得到白色沉淀和上层无色清液;
(2)过滤后,在滤出的白色沉淀里加入稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体能使澄清石灰水变浑浊;
(3)在滤液中,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的无色气体,该气体能使湿润的红色石蕊试纸变蓝.
由此实验推断:该粉末中一定含有Na2SO4、NH4NO3、CaCO3、BaCl2;
一定不含有CuSO4;可能含有KNO3.(填化学式)
分析 由题意知溶液无色.则推知不含CuSO4溶液,有白色沉淀产生,可以推知有本身不溶于水的CaCO3存在或能相互反应生成BaSO4的Na2SO4和BaCl2的存在,然后依据加入稀硝酸沉淀部分溶解,则可以推断两种沉淀均存在,又通过加入强碱产生有刺激性气味的其体可以推断含有NH4NO3,对于KNO3只能为可能含有,以此解答该题.
解答 解:(1)将此固体粉末加到水中,得到白色沉淀和上层无色清液,由于硫酸铜溶液是蓝色的,故一定不含有CuSO4;得到的白色沉淀可能是CaCO3或BaSO4;
(2)过滤后,在滤出的白色沉淀里加入稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体使澄清石灰水变浑浊,由于碳酸钙能与硝酸反应生成二氧化碳,故一定含有CaCO3;硫酸钡是不溶于稀硝酸的白色沉淀,故一定有BaSO4,所以原固体中含有Na2SO4和BaCl2;
(3)在滤液中,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的无色气体,该气体能使湿润的红色石蕊试纸变蓝,说明生成了氨气,铵态氮肥能与碱性物质反应产生氨气,故原固体中一定含有NH4NO3,不能确定是否含有KNO3,
故答案为:Na2SO4、NH4NO3、CaCO3、BaCl2;CuSO4;KNO3.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力以及元素化合物知识综合理解和运用的考查,注意把握物质的性质以及反应现象的判断,难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
10.用4种溶液进行实验,如表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊 | CaCl2溶液 |
| B | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| D | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.t℃时,CuSO4在水中溶解度为25g,将32gCuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4•5H2O晶体析出,则m的取值范围是( )
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g<m≤180g |
14.500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g)?N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的( )
| A. | 平衡向正反应方向移动,逆反应速率减小 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变大 | |
| D. | 容器内气体颜色先变深后变浅,最后比原来还要浅 |
4.下列关于有机物的叙述中,错误的是( )
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以和金属钠反应放出氢气 | |
| D. | 乙酸可以与乙醇在一定条件下发生酯化反应 |
11.下表是不同温度下水的离子积常数:
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);.
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀,其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
(4)已知25℃时:
用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解.当加碱调节pH为2.7时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L).若上述过程不加H2O2后果和原因是Zn2+和Fe2+分离不开,Fe(OH)2和Zn(OH)2的Ksp相近.(lg2=0.3 lg3=0.48)
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-);.
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀,其主要原因是(用离子方程式表示)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-.
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
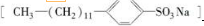 是常用洗涤剂的主要成分.
是常用洗涤剂的主要成分.
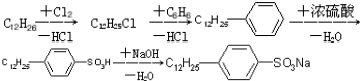
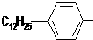 .
.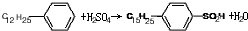 ,反应类型为取代反应.
,反应类型为取代反应.
 .
. .
.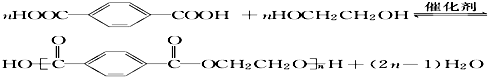 .
.