题目内容
14.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )| A. | 加水稀释2倍后,两溶液的pH均减小 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加适量的醋酸钠晶体后,盐酸pH增大,醋酸pH不变 | |
| D. | 加足量的锌充分反应后,醋酸产生的氢气比盐酸多 |
分析 盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,升高温度能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比.
解答 解:A.pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,故A错误;
B.盐酸是强酸,不存在电离平衡,升高温度基本不影响盐酸的pH,而醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,故B错误;
C.向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,导致溶液的pH增大,向醋酸中加入醋酸钠,能抑制醋酸电离,导致其溶液的pH增大,故C错误;
D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的Fe反应,醋酸产生的氢气比盐酸多,故D正确;
故选D.
点评 本题考查弱电解质电离及其影响,题目难度中等,明确电离平衡及其影响为解答关键,易错选项是B,注意对于相同浓度的盐酸和醋酸溶液,升高温度,盐酸的pH不变,但醋酸的pH改变,为易错点.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
4.下列表示物质结构的化学用语或模型正确的是( )
| A. | HClO的结构式:H-O-Cl | B. | HF的电子式: | ||
| C. | S2-的结构示意图: | D. | CCl4分子的比例模型: |
5.对中国古代著作涉及化学的叙述,下列解说错误的是( )
| A. | 《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油 | |
| B. | 《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐 | |
| C. | 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 | |
| D. | 《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 |
2.已知KHC2O4溶液显酸性,向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是( )
| A. | c(K+)=c(HC2O4-)+c(H2C2O4)+2c(C2O42-) | B. | c(Na+)=c(H2C2O4)+c(C2O42-) | ||
| C. | c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) | D. | c(K+)>c(Na+) |
19.在人类已知的化合物中,品种最多的是( )
| A. | 元素周期表里属于过渡元素的化合物 | |
| B. | 位于元素周期表里第ⅡA族元素的化合物 | |
| C. | 位于元素周期表里第ⅢA族元素的化合物 | |
| D. | 位于元素周期表里第ⅣA族元素的化合物 |
6.如图所示,甲、乙两装置中除了铁片与铜片是否用导线连接外,其余均完全相同.若实验同时开始进行,当反应相同的时间时(反应均未停止),忽略电解质溶液的体积变化,则两装置中仍相同的是( )

| A. | 铁片的质量 | B. | 铜片的质量 | ||
| C. | 生成氢气的体积(同温同压) | D. | H+的物质的量浓度 |
10.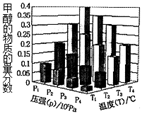 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T1>T3 | D. | P1>P4 T2<T3 |
11.下列物质中,不属于卤代烃的是( )
| A. | CH2Cl2 | B. | CCl2F2 | C. |  | D. |  |