题目内容
16.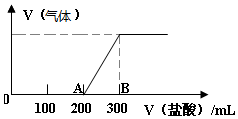 向100mL1.5mol/L的丙溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴缓慢滴加0.5mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示.
向100mL1.5mol/L的丙溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴缓慢滴加0.5mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示.(1)丙溶液与一定量的CO2充分反应后的溶液中溶质为Na2CO3和NaOH(写化学式).
(2)B点时,产生的气体在标准状况下的体积为1.12L.
(3)B点时,反应所得溶液中溶质的物质的量为0.15mol.
分析 (1)CO2与足量的NaOH反应可生成Na2CO3,还有未反应的NaOH;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→B消耗的盐酸的二倍,应为NaOH和Na2CO3的混合物,根据AB段消耗氯化氢溶液的体积、结合方程式计算生成二氧化碳的体积;
(3)B点溶液中溶质为NaCl,由钠离子守恒可知n(NaCl)=n(NaOH),进而计算氯化钠的量.
解答 解:(1)CO2与足量的NaOH反应可生成Na2CO3,还有未反应的NaOH,故溶液中溶质为NaOH和Na2CO3,
故答案为:NaOH和Na2CO3;
(2)加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→B段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,二者都可与盐酸反应,反应的离子方程式分别为:OH-+H+═H2O、CO32-+H+═HCO3-,AB段消耗HCl为0.1L×0.5mol/L=0.05mol,由NaHCO3+HCl═NaCl+H2O+CO2↑,可知生成二氧化碳的物质的量为0.05mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.05mol=1.12L,
故答案为:1.12;
(3)B点溶液中溶质为NaCl,由钠离子守恒可知n(NaCl)=n(NaOH)=0.1L×1.5mol/L=0.15mol,
故答案为:0.15.
点评 本题考查混合物的计算,题目难度中等,关键是根据图象分析各阶段发生的反应,注意计算过程中守恒思想的应用.

练习册系列答案
相关题目
7.根据表中信息,判断下列叙述中正确的是( )
| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 氧化性强弱的比较:KClO3<Cl2 | |
| B. | 第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存 | |
| C. | 第①组的反应,当Cl2与FeBr2物质的量之比≤1:2时,只有一种元素被氧化 | |
| D. | 第③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
1.下列说法或表述正确的是( )
①“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康
②纯碱既属于正盐又属于钠盐和碳酸盐
③相同温度下,氢氧化钠溶液的导电能力与氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应.
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-═Fe2+.
①“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康
②纯碱既属于正盐又属于钠盐和碳酸盐
③相同温度下,氢氧化钠溶液的导电能力与氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应.
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-═Fe2+.
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
8.含碳原子数为1~10的烷烃分子中,其一卤代烷不存在同分异构体的烷烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
5.部分短周期元素的性质或原子结构如表所示.
下列叙述不正确的是( )
| 元素代号 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液显碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 原子半径:W>X>Y | |
| B. | 化合物WY2不溶于水 | |
| C. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 | |
| D. | 最高价氧化物对应水化物的酸性:W<Z |
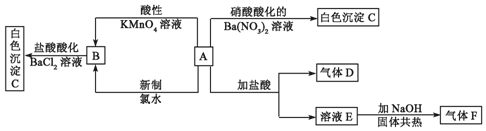
 ;F的结构式
;F的结构式 ;
;
 某学习小组依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为Cu-2e-═Cu2+;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是0.05NA.
某学习小组依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为Cu-2e-═Cu2+;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是0.05NA.