题目内容
4.某无色溶液中只可能含有NH4+、K+、Al3+、Fe3+、Cl-、SO42-等离子中的几种,现按下列步骤进行实验:①该溶液的焰色反应呈现出紫色.
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未碱沉淀产生.
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解,并且随NaOH溶液的加入,沉淀和气体的变化关系如图所示:
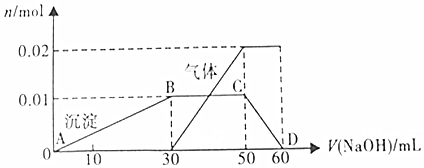
(1)该溶液中一定含有的离子是K+、NH4+、Al3+、SO42-,一定不含有的离子是Cl-、Fe3+.
(2)步骤②中发生反应的离子方程式为SO42-+Ba2+=BaSO4↓.
(3)图中CD段发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)根据图中所示数据,计算实验中使用NaOH溶液的物质的量浓度为1mol/L,焰色反应呈现紫色的离子的物质的量浓度为1mol/L.
分析 ①某无色溶液一定不含Fe3+离子,根据焰色反应的颜色紫色判断K+的存在,根据溶液中离子的颜色解答;
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,生成沉淀为BaSO4,说明溶液中含有SO42-,向滤液中加入AgNO3溶液未见沉淀产生,则溶液中没有Cl-;
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,说明溶液中含有NH4+,最后沉淀完全溶解.则说明溶液中含有Al3+;
(1)根据①②③分析解答;
(2)钡离子和硫酸根离子反应生成白色沉淀硫酸钡不溶于稀硝酸;
(3)氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,并根据弱酸,弱碱,水,氧化物等不拆书写离子方程式;
(4)根据图象纵坐标可判断Al(OH)3和氨气的物质的量;根据Al(OH)3的两性可计算NaOH的浓度;根据图示信息分析该溶液中焰色反应呈现紫色的离子为K+,根据溶液呈电中性解答.
解答 解:①溶液透过蓝色钴玻璃焰色反应呈紫色,说明溶液中含有K+离子,溶液呈无色,则一定不含Fe3+离子;
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,根据SO42-+Ba2+=BaSO4↓知溶液中含有SO42-为0.03mol;向滤液中加入AgNO3溶液未见沉淀产生,则溶液中没有Cl-;
③另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,则说明溶液中含有Al3+,
(1)由①②③得该溶液中一定含有的离子是K+、NH4+、Al3+、SO42-;一定不含有的离子是Cl-、Fe3+,
故答案为:K+、NH4+、Al3+、SO42-;Cl-、Fe3+;
(2)钡离子和硫酸根离子反应生成白色沉淀硫酸钡不溶于稀硝酸,故离子方程式为SO42-+Ba2+=BaSO4↓,
故答案为:SO42-+Ba2+=BaSO4↓;
(3)氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,并根据弱酸,弱碱,水,氧化物等不拆,故离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)Al3++3OH-=Al(OH)3↓,结合图象中沉淀的变化关系,知溶液中含有Al3+为0.01mol需OH-为0.03mol;当沉淀增加到一定量后开始产生气体,根据NH4++OH-=NH3↑+H2O结合图象,知溶液中含有NH4+为0.02mol需OH-为0.02mol;最后沉淀完全溶解是由于氢氧化铝与NaOH继续反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,结合图象中沉淀的变化关系,需OH-为0.01mol;实验中使用的NaOH溶液的总物质的量为:0.03mol+0.02mol+0.01mol=0.06mol,结合图象中沉淀的变化关系知此时氢氧化钠溶液的体积为60mL,根据C=$\frac{n}{V}$=$\frac{0.06mol}{0.06L}$=lmol/L;
根据图示信息分析该溶液中焰色反应呈现紫色的离子为K+,该溶液中一定含有K+、NH4+、Al3+、SO42-;根据(1)③知NH4+为0.02mol,Al3+为0.01mol,SO42-为0.03mol,根据溶液呈电中性溶液中阴阳离子所带的正负电荷总数相等,其中正电荷总数为:0.02mol×1+0.01mol×3+n(K+)×1=0.05mol+n(K+),负电荷总数0.03mol×2=0.06mol,所以n(K+)=0.01mol,根据C=$\frac{n}{V}$=$\frac{0.01mol}{0.01L}$=lmol/L,
故答案为:l;l.
点评 本题考查离子的推断,根据题干提供的实验现象结合离子的性质进行推断,题目难度不大.

| 选项 | 不纯物质 | 除杂试剂 | 分离方法 | 必用仪器 |
| A | 碘(水) | 四氯化碳 | 萃取 | 分液漏斗 |
| B | 氯化钾(氯化钙) | 适量盐酸 | 过滤 | 玻璃棒 |
| C | 硝酸铜(硝酸银) | 适量铜粉 | 结晶 | 酒精灯 |
| D | 硫酸钾(碳酸钾) | 适量盐酸 | 蒸馏 | 温度计 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 正常雨水pH等于7,酸雨的PH小于7 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 |
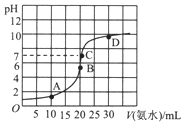 常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )
常温下,向20ml浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,pH随氨水体积的变化如图.下列说法不正确的是( )| A. | 在B点时:c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 在C点时:c(Cl-)<c(NH4+)+c(NH3•H2O) | |
| C. | A点与B点相比:2n(NH4+)>n(NH4+) | |
| D. | 从C到D的过程中,可能出现:c(Cl-)>c(NH4+) |
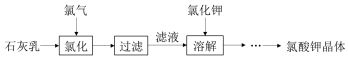
已知:氯化过程主要发生反应 6Ca(OH)2+6Cl2$\stackrel{△}{→}$5CaCl2+Ca(ClO3)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是电解饱和食盐水.
(2)氯化过程需要控制较高温度,其目的有:
①加快反应速率; ②减少 Cl2与 Ca(OH)2之间的副反应.
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:Ca(ClO3)2+2KCl=CaCl2+2KClO3↓.
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是重结晶.
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如表:
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
②该实验不必进行第五次加热的原因是剩余固体质量已恒重,说明KClO3已分解完全.
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况.未在干燥器中冷却,剩余固体吸水(加热时间不足,氯酸钾未完全分解).
| A. | 22.4L氘(D2)气体,含有中子数为2NA | |
| B. | 1.6gNH2-离子所含电子数为NA | |
| C. | 4g氦气所含分子数为0.5NA | |
| D. | NA个SO3分子在标准状况下的体积为22.4L |
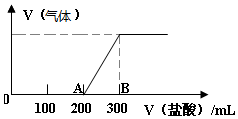 向100mL1.5mol/L的丙溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴缓慢滴加0.5mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示.
向100mL1.5mol/L的丙溶液中缓慢通入一定量的CO2,充分反应后,向所得溶液中逐滴缓慢滴加0.5mol/L的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示.