题目内容
甲、乙、丙三同学欲分别完成“铁与水蒸气反应”的实验.
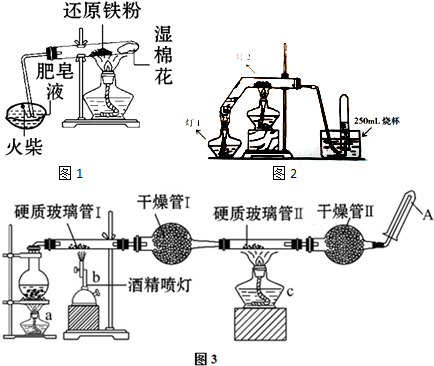
I.甲同学的方案如图1:试管中依次放入湿棉花和还原铁粉,加热.把生成的气体通入蒸发皿中的肥皂液中.一段时间后,用坩埚钳夹取燃着的火柴在蒸发皿中点火,观察到的现象是 ;发生反应的化学方程式为 .
Ⅱ.乙同学所采用的装置如图2:分别用灯1和灯2加热反应器中的水和还原性铁粉,当水蒸气将空气排出后用排水法收集一试管气体.乙同学所采用的装置与甲同学的装置比较优点是 ;结束实验的操作是 .
Ⅲ.丙同学将甲、乙所装置进行改进,所有装置如图3:在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物.
(1)丙同学所采用的装置与乙同学的装置比较优点是 ;
(2)实验开始时应先点燃a处的酒精灯然后才点燃b处的酒精喷灯原因是 ;
(3)能证明铁与水蒸气反应的现象是 ;
Ⅳ.丁同学提出问题:如何通过实验证明铁与水蒸气反应得到的黑色固体中既含Fe2+又含Fe3+ .

I.甲同学的方案如图1:试管中依次放入湿棉花和还原铁粉,加热.把生成的气体通入蒸发皿中的肥皂液中.一段时间后,用坩埚钳夹取燃着的火柴在蒸发皿中点火,观察到的现象是
Ⅱ.乙同学所采用的装置如图2:分别用灯1和灯2加热反应器中的水和还原性铁粉,当水蒸气将空气排出后用排水法收集一试管气体.乙同学所采用的装置与甲同学的装置比较优点是
Ⅲ.丙同学将甲、乙所装置进行改进,所有装置如图3:在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物.
(1)丙同学所采用的装置与乙同学的装置比较优点是
(2)实验开始时应先点燃a处的酒精灯然后才点燃b处的酒精喷灯原因是
(3)能证明铁与水蒸气反应的现象是
Ⅳ.丁同学提出问题:如何通过实验证明铁与水蒸气反应得到的黑色固体中既含Fe2+又含Fe3+
考点:性质实验方案的设计
专题:
分析:I.金属铁在高温下可以和水蒸气之间发生反应生成四氧化三铁和氢气,根据产物的性质进行回答;
II.根据实验装置的特点结合反应来确定装置的优点,试验中要防止倒吸,由此确定加热装置的处理方法;
Ⅲ.(1)丙同学所采用的装置与乙同学的装置对比区别之处得出结论;
(2)空气中的氧气会和金属铁反应,进行金属铁和水蒸气的反应试验,为防止干扰,应该将空气排净;
(3)根据金属铁在高温下可以和水蒸气之间发生反应生成黑色的四氧化三铁和固体和氢气,氢气点燃会产生水蒸气,由此回答;
Ⅳ.亚铁离子遇到高锰酸钾会使之褪色,铁离子遇到硫氰化钾显示红色,据此检验铁离子、亚铁离子的存在.
II.根据实验装置的特点结合反应来确定装置的优点,试验中要防止倒吸,由此确定加热装置的处理方法;
Ⅲ.(1)丙同学所采用的装置与乙同学的装置对比区别之处得出结论;
(2)空气中的氧气会和金属铁反应,进行金属铁和水蒸气的反应试验,为防止干扰,应该将空气排净;
(3)根据金属铁在高温下可以和水蒸气之间发生反应生成黑色的四氧化三铁和固体和氢气,氢气点燃会产生水蒸气,由此回答;
Ⅳ.亚铁离子遇到高锰酸钾会使之褪色,铁离子遇到硫氰化钾显示红色,据此检验铁离子、亚铁离子的存在.
解答:
解:I.金属铁在高温下可以和水蒸气之间发生反应生成黑色的四氧化三铁和氢气:3Fe+4H2O(g)
Fe3O4+4H2,所以会看到蒸发皿中产生大量肥皂泡,点燃放出的气体氢气,能燃烧或发生爆鸣,反应后,试管中固体仍呈黑色,
故答案为:蒸发皿中产生大量肥皂泡,点燃放出的气体,能燃烧或发生爆鸣,反应后,试管中固体仍呈黑色;3Fe+4H2O(g)
Fe3O4+4H2;
II.乙同学所采用的装置能够保证有足够的水蒸气进入反应器,并且用小试管收集并检验生成的气体更科学,为了防止倒吸引发实验事故,应该先把导管从烧杯中取出,熄灭灯1待反应器中水蒸气排净后移走灯2.
故答案为:保证有足够的水蒸气进入反应器,用小试管收集并检验生成的气体更科学;先把导管从烧杯中取出,熄灭灯1待反应器中水蒸气排净后移走灯2;
Ⅲ.(1)丙同学所采用的装置与乙同学的装置对比,丙同学用酒精喷灯反应温度高效果好,硬质玻璃管Ⅱ中加入CuO可以和氢气反应得到红色的金属铜以及水,据此可直接证明反应生成H2;
故答案为:用酒精喷灯反应温度高效果好,硬质玻璃管Ⅱ中加入CuO可直接证明反应生成H2;
(2)空气中的氧气会和金属铁反应,进行金属铁和水蒸气的反应试验,为防止干扰,应该将空气排净,故答案为:先点燃a处的酒精灯,产生的水蒸气排净装置中的空气,防止加热铁粉与空气反应;
(3)金属铁在高温下可以和水蒸气之间发生反应生成黑色的四氧化三铁和固体和氢气,CuO可以和氢气反应得到红色的金属铜以及水,硬质玻璃管Ⅱ中黑色固体变红,氢气点燃会产生水蒸气,干燥管Ⅱ中白色固体变蓝.
故答案为:硬质玻璃管Ⅱ中黑色固体变红,干燥管Ⅱ中白色固体变蓝;
Ⅳ.四氧化三铁溶于盐酸中,会生成氯化铁和氯化亚铁的混合物,亚铁离子遇到高锰酸钾会使之褪色,铁离子遇到硫氰化钾显示红色,据此检验铁离子以及亚铁离子的存在情况即可.
故答案为:将黑色固体溶于盐酸,将所得溶液分为两份,向其中一份中加入KSCN溶液,若溶液变成红色,证明含有Fe3+;向另一份溶液中加入KMnO4(H+)溶液,若溶液紫红色褪去,证明含有Fe2+.
| ||
故答案为:蒸发皿中产生大量肥皂泡,点燃放出的气体,能燃烧或发生爆鸣,反应后,试管中固体仍呈黑色;3Fe+4H2O(g)
| ||
II.乙同学所采用的装置能够保证有足够的水蒸气进入反应器,并且用小试管收集并检验生成的气体更科学,为了防止倒吸引发实验事故,应该先把导管从烧杯中取出,熄灭灯1待反应器中水蒸气排净后移走灯2.
故答案为:保证有足够的水蒸气进入反应器,用小试管收集并检验生成的气体更科学;先把导管从烧杯中取出,熄灭灯1待反应器中水蒸气排净后移走灯2;
Ⅲ.(1)丙同学所采用的装置与乙同学的装置对比,丙同学用酒精喷灯反应温度高效果好,硬质玻璃管Ⅱ中加入CuO可以和氢气反应得到红色的金属铜以及水,据此可直接证明反应生成H2;
故答案为:用酒精喷灯反应温度高效果好,硬质玻璃管Ⅱ中加入CuO可直接证明反应生成H2;
(2)空气中的氧气会和金属铁反应,进行金属铁和水蒸气的反应试验,为防止干扰,应该将空气排净,故答案为:先点燃a处的酒精灯,产生的水蒸气排净装置中的空气,防止加热铁粉与空气反应;
(3)金属铁在高温下可以和水蒸气之间发生反应生成黑色的四氧化三铁和固体和氢气,CuO可以和氢气反应得到红色的金属铜以及水,硬质玻璃管Ⅱ中黑色固体变红,氢气点燃会产生水蒸气,干燥管Ⅱ中白色固体变蓝.
故答案为:硬质玻璃管Ⅱ中黑色固体变红,干燥管Ⅱ中白色固体变蓝;
Ⅳ.四氧化三铁溶于盐酸中,会生成氯化铁和氯化亚铁的混合物,亚铁离子遇到高锰酸钾会使之褪色,铁离子遇到硫氰化钾显示红色,据此检验铁离子以及亚铁离子的存在情况即可.
故答案为:将黑色固体溶于盐酸,将所得溶液分为两份,向其中一份中加入KSCN溶液,若溶液变成红色,证明含有Fe3+;向另一份溶液中加入KMnO4(H+)溶液,若溶液紫红色褪去,证明含有Fe2+.
点评:本题目是一道关于金属铁和水反应的实验方案设计和评价提,解题的关键是掌握反应的产物的性质以及物质检验的基本知识,难度较大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
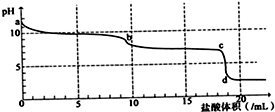 常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )| A、a点时溶液pH=11.5,原因是:CO32-+H2O→HCO3-+OH- |
| B、a-b段发生反应为:CO32-+2H+→CO2↑+H2O |
| C、b-c段发生反应为:HCO3-+H+→CO2↑+H2O |
| D、c-d段发生反应为:H++OH-→H2O |
下列叙述正确的是( )
| A、硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B、常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小 |
| C、NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3) |
| D、等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
某种混合气体,可能含有N2、HCl和CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化,经干燥后再通过足量的Na2O2固体,气体体积减少,最后通过灼热的铜网,经充分反应后,气体体积又减少,但还有剩余气体,以下对混合气体区分的判断,正确的是( )
| A、一定没有N2,CO和HCl中至少有一种 |
| B、一定没有N2,CO和HCl都有 |
| C、一定有N2,CO和HCl中至少有一种 |
| D、一定有N2和HCl,肯定没有CO |

 ,R、R′均为烃基
,R、R′均为烃基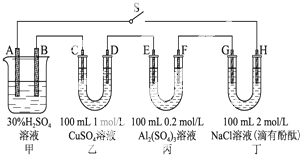 如图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极.甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4
如图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极.甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4