题目内容
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
I.铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草
酸根恰好全部氧化成二氧化碳,同时,Mn04-被还原成Mn2+.向反应后的溶液中加入一小
匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,
溶液仍呈酸性.
步骤三:用0.010mol?L-1KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液.
02mL,滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMn04溶液19.98mL
请回答下列问题:
(1)步骤一中配制三草酸合铁酸钾溶液使用到的玻璃仪器包括:烧杯、玻璃棒、 、
(2)步骤二中加入锌粉至黄色刚好消失,目的是
(3)写出步骤三中发生反应的离子方程式 .
(4)根据实验数据,测得该晶体中铁元素的质量分数为
(5)若步骤二中加入的KMnO4的溶液的量不足,则测得的铁含量 (选填填“偏低”“偏高”或“不变”)
Ⅱ.结晶水的测定
(6)采用热重分析仪测定三革酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)在1 0℃时的失重率为a%,则晶体化学式中结晶水的个数x的计算式为)
(已知:三草酸合铁酸钾的摩尔质量M(K3[Fe(C2O4)3])=510g?mol-1)
I.铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草
酸根恰好全部氧化成二氧化碳,同时,Mn04-被还原成Mn2+.向反应后的溶液中加入一小
匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,
溶液仍呈酸性.
步骤三:用0.010mol?L-1KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液.
02mL,滴定中MnO4-被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMn04溶液19.98mL
请回答下列问题:
(1)步骤一中配制三草酸合铁酸钾溶液使用到的玻璃仪器包括:烧杯、玻璃棒、
(2)步骤二中加入锌粉至黄色刚好消失,目的是
(3)写出步骤三中发生反应的离子方程式
(4)根据实验数据,测得该晶体中铁元素的质量分数为
(5)若步骤二中加入的KMnO4的溶液的量不足,则测得的铁含量
Ⅱ.结晶水的测定
(6)采用热重分析仪测定三革酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)在1 0℃时的失重率为a%,则晶体化学式中结晶水的个数x的计算式为)
(已知:三草酸合铁酸钾的摩尔质量M(K3[Fe(C2O4)3])=510g?mol-1)
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤;
(2)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(3)根据物质的性质和书写离子方程式的有关要求书写离子方程式;
(4)根据离子方程式计算;
(5)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
(6)根据水的物质的量求出x.
(2)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(3)根据物质的性质和书写离子方程式的有关要求书写离子方程式;
(4)根据离子方程式计算;
(5)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
(6)根据水的物质的量求出x.
解答:
解:(1)在配制三草酸合铁酸钾溶液时,使用到的玻璃仪器包括:烧杯、玻璃棒,还需要250mL容量瓶、定容需要胶头滴管;故答案为:250mL容量瓶、胶头滴管;
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,故答案为:将Fe3+恰好还原成Fe2+;
(3)在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×
×0.01 mol?L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g?mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=
×100%=11.2%,故答案为:11.2%;
(5)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.故答案为:偏高;
(6)采用热重分析仪测定三革酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)在1 0℃时的失重率为a%,则m(H2O)=(510+18x)a%,根据水物质的量,x=
,x=
;故答案为:
.
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,故答案为:将Fe3+恰好还原成Fe2+;
(3)在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×
| 20.02mL+19.98mL |
| 2 |
| 0.56g |
| 5g |
(5)若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.故答案为:偏高;
(6)采用热重分析仪测定三革酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)在1 0℃时的失重率为a%,则m(H2O)=(510+18x)a%,根据水物质的量,x=
| (510+18x)a% |
| 18 |
| 5.1a |
| 18(1-a%) |
| 5.1a |
| 18(1-a%) |
点评:本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.

练习册系列答案
相关题目
下列说法正确的是( )
| A、光导纤维的主要成分是硅 |
| B、水晶项链是硅单质制品 |
| C、利用盐酸刻蚀石英制作艺术品 |
| D、硅酸钠是制备木材防火剂的原料 |
关于 16O和18O的说法正确的是( )
| A、16O与18O互为同分异构体 |
| B、16O与18O核外电子排布不同 |
| C、通过化学变化可以实现16O与18O间的转化 |
| D、标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子 |
 草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.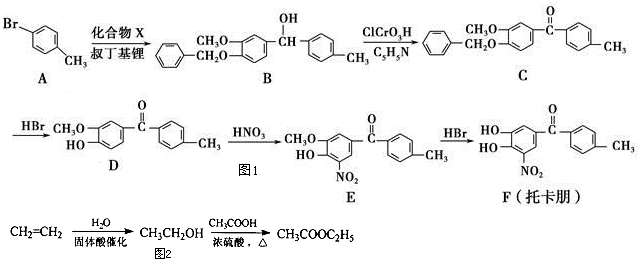
 的衍生物,且取代基都在同一个苯环上;
的衍生物,且取代基都在同一个苯环上;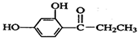 是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和
是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和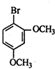 为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2:
为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2: