题目内容
下列叙述正确的是( )
| A、硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B、常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小 |
| C、NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3) |
| D、等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、溶液呈中性,说明c(OH-)=c(H+),结合电荷守恒判断;
B、(NH4)2CO3 中铵根促进碳酸根的水解,Na2CO3溶液中只有碳酸根水解;
C、利用质子守恒以及物料守恒解答即可;
D、如果溶液呈酸性,则HX的电离程度大于X-的水解程度.
B、(NH4)2CO3 中铵根促进碳酸根的水解,Na2CO3溶液中只有碳酸根水解;
C、利用质子守恒以及物料守恒解答即可;
D、如果溶液呈酸性,则HX的电离程度大于X-的水解程度.
解答:
解:A、溶液呈中性,说明c(OH-)=c(H+),溶液中存在电荷守恒判断2c(SO42-)+c(OH-)=c(H+)+c(NH4+),所以2c(SO42-)=c(NH4+),故A错误;
B、(NH4)2CO3 中铵根促进碳酸根的水解,Na2CO3溶液中只有碳酸根水解,故前者的c(HCO3-)的大,故B错误;
C、Na和C原子守衡:溶液中Na的存在形式是Na+,C的存在形式有:H2CO3、HCO3-、CO32-、所以有:①c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-);溶液中阳离子有Na+和H+,阴离子有HCO3-、CO32-、OH-,所以有:②c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-);将①代入②,可得:c(CO32-)+c (OH-)=c (H+)+c(H2CO3),故C正确;
D、等体积等物质的量浓度的NaX和弱酸HX混合后的溶液显碱性,说明X-的水解程度大于HX的电离程度,则c(X-)<c(HX),但是依据物料守恒得出:c(Na+)<c(HX),故D错误,
故选C.
B、(NH4)2CO3 中铵根促进碳酸根的水解,Na2CO3溶液中只有碳酸根水解,故前者的c(HCO3-)的大,故B错误;
C、Na和C原子守衡:溶液中Na的存在形式是Na+,C的存在形式有:H2CO3、HCO3-、CO32-、所以有:①c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-);溶液中阳离子有Na+和H+,阴离子有HCO3-、CO32-、OH-,所以有:②c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-);将①代入②,可得:c(CO32-)+c (OH-)=c (H+)+c(H2CO3),故C正确;
D、等体积等物质的量浓度的NaX和弱酸HX混合后的溶液显碱性,说明X-的水解程度大于HX的电离程度,则c(X-)<c(HX),但是依据物料守恒得出:c(Na+)<c(HX),故D错误,
故选C.
点评:本题主要考查的是溶液中离子浓度大小比较,利用物料守恒、质子守恒等解题,难度较大.

练习册系列答案
相关题目
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与稀硫酸的反应 OH-+H+=H2O |
| B、氧化钙与稀盐酸反应CaO+2H+=Ca2++H2O |
| C、铁片插入硝酸银溶液中Fe+Ag+=Fe2++Ag |
| D、碳酸钙溶于稀硝酸中 CO32++2H+=CO2↑+H2O |
某溶液中含有HCO3-、Na+、Ba2+、NO3-4种离子,若向其中加入少量Na2O2固体后溶液中离子浓度基本保持不变的是( )
| A、HCO3- |
| B、Na+ |
| C、Ba2+ |
| D、NO3- |
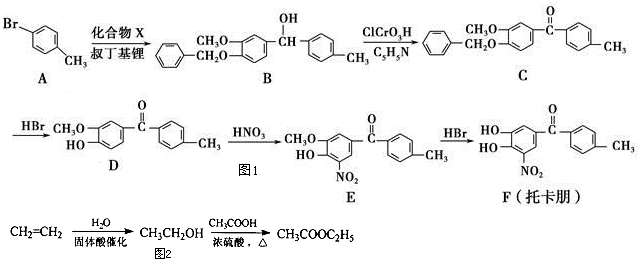
 的衍生物,且取代基都在同一个苯环上;
的衍生物,且取代基都在同一个苯环上;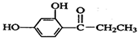 是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和
是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和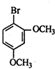 为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2:
为原料(原流程图中的试剂及无机试剂任用)该化合物的合成路线流程图.合成路线流程图示例如图2: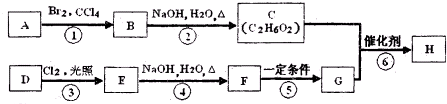
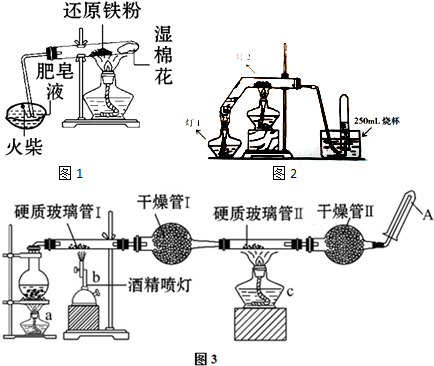
 实验室配制480mL 0.05mol/L的FeSO4溶液,实验操作步骤有:
实验室配制480mL 0.05mol/L的FeSO4溶液,实验操作步骤有: