题目内容
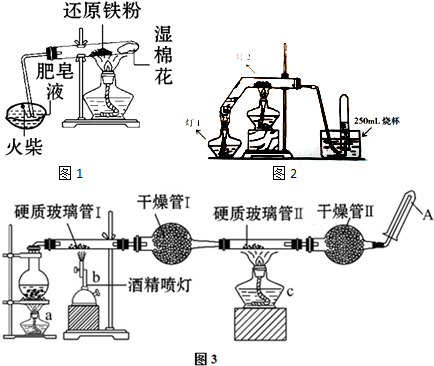
 常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如图,则下列说法正确的是( )| A、a点时溶液pH=11.5,原因是:CO32-+H2O→HCO3-+OH- |
| B、a-b段发生反应为:CO32-+2H+→CO2↑+H2O |
| C、b-c段发生反应为:HCO3-+H+→CO2↑+H2O |
| D、c-d段发生反应为:H++OH-→H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:碳酸钠为强碱弱酸盐,水解显碱性,向碳酸钠溶液中逐滴滴加盐酸,碳酸根离子先与氢离子反应生成碳酸氢根离子,然后碳酸氢根离子再与氢离子反应生成二氧化碳和水,结合图象解答.
解答:
解:A.a点溶液显碱性,是碳酸根离子水解的原因,离子方程式为:CO32-+H2O→HCO3-+OH-,故A正确;
B.a-b段发生碳酸根离子与氢离子反应生成碳酸氢根离子,离子方程式为:CO32-+H+=HCO3-,故B错误;
C.b-c段发生碳酸氢根离子与氢离子反应生成二氧化碳和水,离子方程式为:HCO3-+H+→CO2↑+H2O,故C正确;
D.c-d段,盐酸过量,不发生反应,故D错误;
故选:AC.
B.a-b段发生碳酸根离子与氢离子反应生成碳酸氢根离子,离子方程式为:CO32-+H+=HCO3-,故B错误;
C.b-c段发生碳酸氢根离子与氢离子反应生成二氧化碳和水,离子方程式为:HCO3-+H+→CO2↑+H2O,故C正确;
D.c-d段,盐酸过量,不发生反应,故D错误;
故选:AC.
点评:本题考查了离子方程式的书写,明确碳酸根离子与氢离子反应的实质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图的原电池工作时,下列叙述正确的是( )


| A、负极反应为:Cu2++2e-=Cu |
| B、在外电路中,电流从负极流向正极 |
| C、电池总反应为:Zn+Cu2+=Zn2++Cu |
| D、盐桥中的阳离子移向负极 |
下列说法正确的是( )
| A、光导纤维的主要成分是硅 |
| B、水晶项链是硅单质制品 |
| C、利用盐酸刻蚀石英制作艺术品 |
| D、硅酸钠是制备木材防火剂的原料 |
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、1mol钠和足量水反应可生成11.2L氢气 |
| B、常温常压下,32g氧气中含有2NA个氧分子 |
| C、1mol/LK2SO4溶液中,含有2mol钾离子 |
| D、标准状况下,22.4LHCl溶于水后溶液中含有NA个氢离子 |
能正确表示下列化学反应的离子方程式的是( )
| A、氢氧化钡溶液与稀硫酸的反应 OH-+H+=H2O |
| B、氧化钙与稀盐酸反应CaO+2H+=Ca2++H2O |
| C、铁片插入硝酸银溶液中Fe+Ag+=Fe2++Ag |
| D、碳酸钙溶于稀硝酸中 CO32++2H+=CO2↑+H2O |
下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A、烧碱、液氯、碘酒 |
| B、生石灰、白磷、小苏打 |
| C、干冰、铁红、氯化氢 |
| D、空气、氮气、胆矾 |
关于 16O和18O的说法正确的是( )
| A、16O与18O互为同分异构体 |
| B、16O与18O核外电子排布不同 |
| C、通过化学变化可以实现16O与18O间的转化 |
| D、标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子 |
 草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.