题目内容
16.根据下列反应:①2Fe2++Cl2═2Fe3++2Cl-
②2Fe3++Cu═Cu2++2Fe2+
③Fe+Cu2+═Fe2++Cu
④HClO+H++Cl-═Cl2+H2O
则判断下列各组物质的氧化性由强到弱的顺序正确的是( )
| A. | Cl2>Fe3+>HClO>Cu2+>Fe2+ | B. | Cl2>HClO>Fe3+>Cu2+>Fe2+ | ||
| C. | HClO>Cl2>Fe3+>Cu2+>Fe2+ | D. | HClO>Fe3+>Cl2>Cu2+>Fe2+ |
分析 根据反应方程式进行比较:氧化剂+还原剂=还原产物+氧化产物;氧化性为氧化剂>氧化产物,还原性为还原剂>还原产物,据此判断.
解答 解:根据①反应可知氧化剂为Cl2、氧化产物为Fe3+,所以氧化性:Cl2>Fe3+,
根据②可知,氧化剂Fe3+、氧化产物为Cu2+,所以氧化性:Fe3+>Cu2+,
根据?③可知,氧化剂Cu2+、氧化产物为Fe2+,所以氧化性:Cu2+>Fe2+,
根据?④可知,氧化剂HClO、氧化产物为Cl2,所以氧化性:HClO>Cl2,
故氧化性顺序为:HClO>Cl2>Fe3+>Cu2+>Fe2+,故C正确;
故选C.
点评 本题考查了根据方程式来比较氧化性和还原性,解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
7.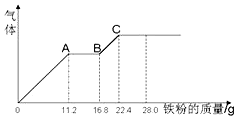 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原溶液中H2SO4浓度为4mol•L-1 | |
| B. | 图中,AB段的反应为2Fe3++Fe=3Fe2+,A点的溶质为Fe(NO3)3 | |
| C. | 原混合液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生是NO,BC段产生的气体是氢气 |
4.下列氧化还原反应所标出的电子转移情况中没有错误的是( )
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
11.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| B. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
1.下列物质的溶液长期暴露在空气中会变质而溶液又会出现白色浑浊的是( )
| A. | NaHCO3 | B. | FeCl2 | C. | KI | D. | Na 2SiO 3 |
8.下列事实不能用元素周期律解释的是( )
| A. | 碱性:KOH>NaOH | B. | 相对分子质量:Ar>K | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
6.下列图中的实验方案,能达到实验目的是( )
| A. |  可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. |  可用于制取乙烯并检验乙烯 | |
| C. |  可以验证FeCl3对H2O2分解反应有催化作用 | |
| D. |  先从①口进气集满CO2,再从②口进气,可用于收集NO |