题目内容
6.将一定质量Na2CO3和NaHCO3的均匀混合物分成两等份.其中一份直接加热至恒重,质量减轻了1.24g;另一份加入40mL某浓度盐酸恰好完全反应,生成标准状况下气体2.24L.试计算:
(1)混合物中的NaHCO3物质的量为0.08mol.
(2)盐酸的浓度为4mol/L.
分析 (1)固体加热时发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,利用差量法可计算原混合物中NaHCO3质量,进而计算碳酸氢钠的质量;
(2)收集到标准状况下2.24L气体,所以一份中碳酸钠和碳酸氢钠的物质的量之和为0.1mol,所以碳酸钠的物质的量为0.06mol,与一定量某浓度的盐酸至恰好反应完全,生成氯化钠,所以盐酸的物质的量为:0.04+0.06×2=0.16mol,根据c=$\frac{n}{V}$.
解答 解:(1)固体加热时发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
168g 62g
x 1.24g,
x=$\frac{168×1.24}{62}$=3.36g,n(NaHCO3)=$\frac{3.36g}{84g/mol}$=0.04mol,
原均匀混合物中NaHCO3的物质的量n(NaHCO3)=0.04mol×2=0.08mol,故答案为:0.08;
(2)收集到标准状况下2.24L气体,所以一份中碳酸钠和碳酸氢钠的物质的量之和为0.1mol,所以碳酸钠的物质的量为0.06mol,与一定量某浓度的盐酸至恰好反应完全,生成氯化钠,所以盐酸的物质的量为:0.04+0.06×2=0.16mol,所以盐酸的浓度c(HCl)=$\frac{n}{V}$=$\frac{0.16mol}{0.04L}$=4mol/L,故答案为:4.
点评 本题考查混合物的有关计算,清楚发生的反应时解题关键,难度中等,(1)中利用差量法计算,结合计算过程,(2)注意利用守恒思想进行计算.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案 含氯苯(
含氯苯( )的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )
)的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )| A. | A极为负极,发生氧化反应 | B. | H+由A极穿过质子交换膜到达B极 | ||
| C. | A 极电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | D. | 反应后电解液的pH升高 |
 某有机物的结构简式如图,它可能发生的反应类型有( )
某有机物的结构简式如图,它可能发生的反应类型有( )①取代 ②加成 ③消去 ④水解⑤酯化 ⑥中和 ⑦氧化 ⑧加聚.
| A. | ①②③④⑥ | B. | ②③④⑤⑧ | C. | ③④⑤⑥⑦ | D. | ①②③⑤⑥⑦ |
| A. | 标准状况下,22.4LCl2与足量的铁粉反应,转移的电子数为3NA | |
| B. | 含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间 | |
| C. | 在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA | |
| D. | 5NH4NO3$\frac{\underline{\;△\;}}{\;}$4N2↑+2HNO3+9H2O中氧化产物比还原产物每多14g,转移电子数为15NA |
①H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)=$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)=S(g)+H2O(g)△H3④S(g)=$\frac{1}{2}$S2(g)△H4.
| A. | △H4=$\frac{1}{3}$(3△H3-△H1-△H2) | B. | △H4=$\frac{1}{3}$(△H1+△H2-3△H3) | ||
| C. | △H4=$\frac{3}{4}$(△H1+△H2-3△H3) | D. | △H4=$\frac{3}{4}$(△H1-△H2-3△H3) |
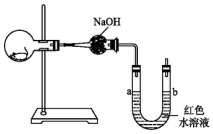 如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )
如图所示,烧瓶内有一只活的小白鼠,U形管内装有红色水溶液,使a、b两端的液面处于同一水平面.经数小时后,U形管a、b两处的液面会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响)( )| A. | a端下降,b端上升 | B. | a端上升,b端下降 | C. | a、b两端都下降 | D. | a、b两端都上升 |
①2Fe2++Cl2═2Fe3++2Cl-
②2Fe3++Cu═Cu2++2Fe2+
③Fe+Cu2+═Fe2++Cu
④HClO+H++Cl-═Cl2+H2O
则判断下列各组物质的氧化性由强到弱的顺序正确的是( )
| A. | Cl2>Fe3+>HClO>Cu2+>Fe2+ | B. | Cl2>HClO>Fe3+>Cu2+>Fe2+ | ||
| C. | HClO>Cl2>Fe3+>Cu2+>Fe2+ | D. | HClO>Fe3+>Cl2>Cu2+>Fe2+ |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: