题目内容
 某学生设计了如图所示的“黑笔写红字”的趣味实验.滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹--“Beijing2008”. 据此,下列叙述不正确的是( )
某学生设计了如图所示的“黑笔写红字”的趣味实验.滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹--“Beijing2008”. 据此,下列叙述不正确的是( )| A、铅笔作阴极:电极反应为:2H++2e-=H2↑ | ||||
| B、铂片作阳极:电极反应为:2Cl--2e-=Cl2↑ | ||||
| C、铅笔与滤纸接触处有少量Cl2逸出 | ||||
D、上述反应总的离子方程式可表示为2Cl-+2H2O
|
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置为电解池,铅笔写出的字呈红色,说明铅笔附近有氢氧化钠生成,则铅笔作阴极,铂片作阳极,电解时的阴极反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,阳极发生的反应为:2Cl--2e-═Cl2↑,总反应为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑,阴极溶液呈碱性,滴加酚酞溶液呈红色.
| ||
解答:
解:A.铅笔写出的字呈红色,说明铅笔附近有氢氧化钠生成,则铅笔作阴极,阴极反应为:2H++2e-═H2↑,故A正确;
B.铅笔作阴极,铂片作阴极,阳极发生的反应为:2Cl--2e-═Cl2↑,故B正确;
C.铅笔做阴极,阴极上氢离子得电子生成氢气,所以铅笔与滤纸接触处有氢气产生,故C错误;
D.电解时的阴极反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,阳极发生的反应为:2Cl--2e-═Cl2↑,总反应为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故D正确;
故选:C.
B.铅笔作阴极,铂片作阴极,阳极发生的反应为:2Cl--2e-═Cl2↑,故B正确;
C.铅笔做阴极,阴极上氢离子得电子生成氢气,所以铅笔与滤纸接触处有氢气产生,故C错误;
D.电解时的阴极反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,阳极发生的反应为:2Cl--2e-═Cl2↑,总反应为:2Cl-+2H2O
| ||
故选:C.
点评:本题考查电解原理,根据实验现象确定阴阳极,从而确定原电池正负极,注意阴阳极上发生的电极反应及溶液中离子浓度变化,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、PM 2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶而对人体产生危害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、地沟油对身体有害不能用作食用油,但可以在循环经济中发挥作用 |
D、塑化剂的基本结构为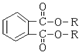 ,因此可以水解成对人体无害的物质 ,因此可以水解成对人体无害的物质 |
用下列实验装置进行相应的实验,能够达到实验目的是( )
 |  |  |  |
| A实验室制取少量的硝基苯 | B证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 | C分离乙酸乙酯、碳酸钠和水的混合物 | D在实验室测定中和反应的反应热 |
| A、A | B、B | C、C | D、D |
下列有关叙述中正确的是( )
| A、碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质 |
| B、NH3的水溶液导电,所以NH3是电解质 |
| C、强电解质在水溶液中的电离过程是不可逆的 |
| D、强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 |
下列方程式或离子方程式正确的是( )
| A、少量CO2气体通入Ca(ClO)2溶液中:CO2+2ClO-+H2O═CO32-+2HClO |
| B、1mol?L-1的Na[Al(OH)4]溶液和2.5mol?L-1的盐酸等体积混合:2[Al(OH)4]-+5H+═Al(OH)3↓+Al3++5H2O |
| C、等体积、等物质的量浓度的NaHCO3和 Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| D、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
| B、2 L 0.5 mol?L-1硫酸钾溶液中阴离子所带电荷数为NA |
| C、1 mol Na2O2固体中含离子总数为4NA |
| D、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
下列装置或操作能达到实验目的是( )
A、 实验室制取并收集NH3 |
B、 构成铜锌原电池 |
C、 检查装置气密性 |
D、 利用排空气法收集CO2 |
奥运五环代表着全世界五大洲的人民团结在一起.下列各项中的物质能满足如图中阴影部分关系的是( )


| A、①NaCl;②K2SO4;③KCl;④(NH4)2SO4; |
| B、①Na2SO4;②K2SO4;③KCl;④(NH4)2SO4; |
| C、①NaCl;②K2SO4;③KCl;④NH4Cl; |
| D、①Na2SO4;②K2SO4;③KCl;④NH4Cl. |
下列物质:①水泥 ②玻璃 ③陶瓷 ④水晶,其中属于硅酸盐工业产品的是( )
| A、只有①② | B、只有②④ |
| C、只有①②③ | D、全部 |