题目内容
下列物质是电解质的为( )
| A、氨气 | B、硫酸钡 |
| C、水玻璃 | D、硝酸钾溶液 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,以此来解答.
解答:
解:A.氨气和水反应生成一水合氨,一水合氨能电离出自由移动的阴阳离子,所以氨气的水溶液导电,但电离出离子的物质是一水合氨不是氨气,所以氨气是非电解质,故A错误;
B.硫酸钡熔融状态能导电,属于电解质,故B正确;
C.水玻璃为硅酸钠水溶液为混合物,则不属于电解质,故C错误;
D.硝酸钾溶液是混合物,则不属于电解质,故D错误;
故选B.
B.硫酸钡熔融状态能导电,属于电解质,故B正确;
C.水玻璃为硅酸钠水溶液为混合物,则不属于电解质,故C错误;
D.硝酸钾溶液是混合物,则不属于电解质,故D错误;
故选B.
点评:本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
某溶液中除了H+、OH-以外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量浓度之比为1:1:6,下列有关该溶液判断正确的是( )
| A、向该溶液中加入KI溶液后,原有的5种离子的物质的量不变 |
| B、向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 |
| C、向该溶液中加入过量铁粉,只发生置换反应 |
| D、若溶液中c (Cl-)=0.6mol/L,则该溶液的pH=1 |
下列叙述正确的是( )
| A、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、HClO见光会分解,故氯水保存在棕色试剂瓶中 |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
已知反应3X(g)+Y(g)?2Z(g)△H>0,T℃时化学平衡常数K=2,在密闭容器中反应达到平衡,下列说法正确的是( )
| A、升高温度平衡常数K减小 |
| B、若压缩体积,平衡向气体体积增大方向移动,混合气体的平均相对分子质量减小 |
| C、保持体积不变,通入稀有气体,压强增大,平衡向正反应方向移动 |
| D、T℃时,向2L密闭容器中加入 2molX、3molY、4molZ,反应将向左进行 |
关于下列各图的叙述正确的是( )
A、 a、b曲线分别表示反应CH3CH3(g)→CH2=CH2(g)+H2(g)(△H>0),使用和未使用催化剂时,反应过程中的能量变化 |
B、 表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C、 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
已建立化学平衡的某可逆反应,改变条件使化学平衡向正反应方向移动,下列有关叙述正确的是( )
| A、此时正反应速率一定大于逆反应速率 |
| B、反应一定放出热量 |
| C、平衡时反应物的浓度一定降低 |
| D、平衡时生成物的质量分数一定增加 |
在密闭容器中一定量混合气体发生反应:xA (g)+yB(g)?zC(g),平衡时测得A的浓度为0.5mol?L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2mol?L-1,下列判断正确的是( )
| A、平衡向正反应方向移动 |
| B、x+y>z |
| C、C的体积分数保持不变 |
| D、B的转化率降低 |
氧化还原反应的实质是( )
| A、原子重新组合 |
| B、有氧元素参加 |
| C、元素化合价发生变化 |
| D、电子的转移(得失或偏移) |
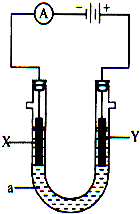 电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图示,是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: