题目内容
15.苯环结构中不存在C-C与C═C的简单交替排列结构,可以作为证据的事实是( )①苯不能使酸性KMnO4溶液褪色
②苯不能使溴水因化学反应而褪色
③经实验测定只有一种结构的邻二甲苯
④苯能在加热和催化剂条件下氢化成环己烷
⑤苯中相邻C原子与C原子间的距离都相等.
| A. | 只有①②③⑤ | B. | 只有④⑤ | C. | ①②③④⑤ | D. | 只有①② |
分析 苯如存在碳碳双键,则可发生加成、加聚和氧化反应,可使溴水、高锰酸钾溶液褪色,如为C-C与C═C的简单交替排列结构,则邻二甲苯存在同分异构体,以此解答该题.
解答 解:①苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故①正确;
②由于苯不因化学变化而使溴水褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故②正确;
③如果是单双键交替结构,邻二甲苯的结构有两种,一种是两个甲基夹C-C,另一种是两个甲基夹C=C.邻二甲苯只有一种结构,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故③正确;
④苯能在一定条件下跟H2加成生成环己烷,发生加成反应是双键或三键具有的性质,不能证明苯环结构中不存在C-C单键与C=C双键的交替结构,故④错误;
⑤苯中相邻碳碳原子间的距离都相等,说明苯环上碳碳键的键长相等,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故⑤正确;
根据分析可知,正确的为:①②③⑤,
故选A.
点评 本题考查有机物的结构和性质,侧重苯的结构额考查,题目难度不大,注意掌握苯分子结构与性质,明确苯分子中的碳碳键为一种介于单键和双键之间的独特键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
10.实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L.,下面四个选项中能达到此目的是( )
| A. | Al3+、K+、SO42-、Cl-、Al[(OH)4]- | B. | Al3+、Na+、Cl-、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、NO3-、Cl- | D. | Fe2+、H+、Br-、NO3-、Cl- |
20.下列说法中,正确的是( )
| A. | 酸碱中和反应是放热反应 | |
| B. | 要加热或高温才能进行的化学反应一定是吸热反应 | |
| C. | 物质发生化学反应一定要有新物质生成但不一定要伴随着能量变化 | |
| D. | 旧的化学键断裂会释放出能量,而要生成新化学键要吸收能量 |
7.下列关于乙烯的叙述中不正确的是( )
| A. | 无色气体,难溶于水,密度比空气略小 | |
| B. | 乙烯燃烧时,火焰明亮,同时产生黑烟 | |
| C. | 与溴水发生取代反应而使溴水褪色 | |
| D. | 乙烯的产量标志着一个国家的石油化工水平 |
18.大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
请回答下列问题:(1)判断该酸雨中肯定不存在的离子是SO32-、Ba2+
(2)写出试液中滴加淀粉KI溶液时发生反应的离子方程式:6I-+2NO3-+8H+=2NO↑+3I2+4H2O
(3)第三份试液滴加NaOH溶液,加热整个过程中有多个反应,写出其中一个反应的离子方程式OH-+H+=H2O,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O.
(4)设计实验方案,检验该溶液中是否存在Cl-:少量试液滴加足量的Ba(NO3)2溶液,静置取上层澄清液加HNO3酸化的AgNO3溶液,若有白色沉淀生成,则证明存在Cl-.
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是催化剂.
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如右图 |  |
(2)写出试液中滴加淀粉KI溶液时发生反应的离子方程式:6I-+2NO3-+8H+=2NO↑+3I2+4H2O
(3)第三份试液滴加NaOH溶液,加热整个过程中有多个反应,写出其中一个反应的离子方程式OH-+H+=H2O,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O.
(4)设计实验方案,检验该溶液中是否存在Cl-:少量试液滴加足量的Ba(NO3)2溶液,静置取上层澄清液加HNO3酸化的AgNO3溶液,若有白色沉淀生成,则证明存在Cl-.
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是催化剂.

 +H2O
+H2O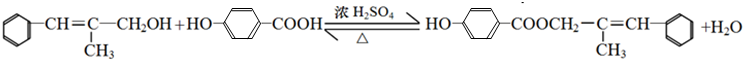
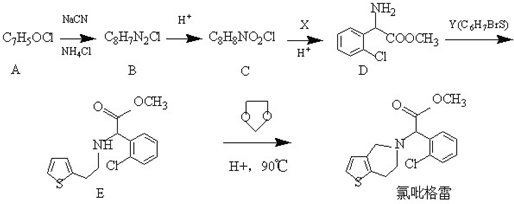
 .
.
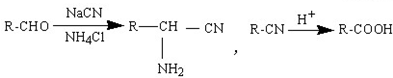
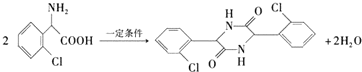 .
. 为有机原料制备化合物的合成路线流程图
为有机原料制备化合物的合成路线流程图 (无机试剂任选).合成路线流程图示例如下:
(无机试剂任选).合成路线流程图示例如下: