题目内容
6.在常温常压下,①CH4②C2H6③C3H8④C4H10.(1)取等物质的量的下列四种气态烃,分别在足量的氧气中燃烧,消耗氧气最多的是C4H10(填分子式).
(2)取等质量的量的下列四种气态烃,分别在足量的氧气中燃烧,消耗氧气最多的是CH4(填分子式).
分析 1mol烃CxHy的耗氧量为(x+$\frac{y}{4}$)mol,据此计算消耗氧气的量;等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,据此进行解答.
解答 解:(1)1molCxHy的耗氧量为(x+$\frac{y}{4}$)mol,由各烃分子式中C、H原子数目可知,相同物质的量各烃C4H10的耗氧量最大,故答案为:C4H10;
(2)等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,C元素质量分数越大,生成二氧化碳越多,CH4、C2H6、C2H2、C4H10的C、H原子数目之比分别为1:4、1:3、1:1、1:2.5,故CH4中氢元素质量分数最大,等质量的各烃中CH4消耗氧气最多,故答案为:CH4.
点评 本题考查有机物分子式确定的计算,题目难度中等,注意根据燃烧通式及质量分数理解耗氧量问题,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.对物质的量浓度相同的溶液的描述正确的是( )
| A. | 溶液的质量相等 | |
| B. | 每升溶液中溶质的质量相等 | |
| C. | 相同体积的溶液,其溶质的物质的量相等 | |
| D. | 每升溶液中溶质的微粒数相等 |
17.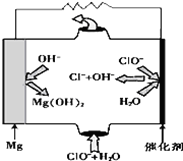 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| C. | 电池工作时,正极周围溶液的碱性将不断减弱 | |
| D. | 电池工作时,OH-向正极移动 |
14.某些建筑材料中含有放射性元素氡(Rn).222Rn、219Rn、220Rn分别来自镭、锕、钍,因而分别称为镭射气、锕射气和钍射气.下列有关氡的说法正确的是( )
| A. | 氡是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡气因其具有放射性而对人体有害 | |
| D. | 222Rn、219Rn、220Rn互为同素异形体 |
1.乙醇分子结构中各化学键如图所示.关于乙醇在各种反应中断键说法不正确的是( )
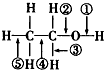
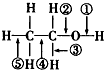
| A. | 在银催化条件下与O2反应时断裂①和③ | |
| B. | 乙醇燃烧是断裂②和⑤ | |
| C. | 和金属钠反应时①断裂 | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
11.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:C(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:C(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
18.铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图1:
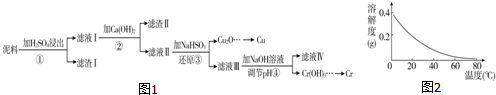
已知:部分物质沉淀的pH如表:
CaSO4的溶解度曲线如图2.
请回答下列问题:
(1)滤液Ⅰ中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加入Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5 mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{64}$≈4.0;lg 4=0.6.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.

已知:部分物质沉淀的pH如表:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
(1)滤液Ⅰ中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加入Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5 mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{64}$≈4.0;lg 4=0.6.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
15.苯环结构中不存在C-C与C═C的简单交替排列结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯不能使溴水因化学反应而褪色
③经实验测定只有一种结构的邻二甲苯
④苯能在加热和催化剂条件下氢化成环己烷
⑤苯中相邻C原子与C原子间的距离都相等.
①苯不能使酸性KMnO4溶液褪色
②苯不能使溴水因化学反应而褪色
③经实验测定只有一种结构的邻二甲苯
④苯能在加热和催化剂条件下氢化成环己烷
⑤苯中相邻C原子与C原子间的距离都相等.
| A. | 只有①②③⑤ | B. | 只有④⑤ | C. | ①②③④⑤ | D. | 只有①② |
16.a L H2和CO的混合气体,充分燃烧后,消耗同温同压下氧气的体积是( )
| A. | a L | B. | $\frac{a}{2}$ L | C. | $\frac{a}{3}$ L | D. | 无法计算 |