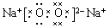题目内容
20.下列说法中,正确的是( )| A. | 酸碱中和反应是放热反应 | |
| B. | 要加热或高温才能进行的化学反应一定是吸热反应 | |
| C. | 物质发生化学反应一定要有新物质生成但不一定要伴随着能量变化 | |
| D. | 旧的化学键断裂会释放出能量,而要生成新化学键要吸收能量 |
分析 A.酸碱中和反应是放热反应;
B.加热或高温条件下发生的反应可能是放热反应,如加热木材的燃烧、铝热反应属于放热反应;
C.化学反应在发生物质变化的同时还伴随着能量的变化;
D.化学反应的本质是旧化学键的断裂与新化学键的形成,断裂化学键需吸收能量,形成化学键需释放能量.
解答 解:A.只要是酸碱中和反应,就一定是放热反应,故A正确;
B.有的放热反应需加热或高温达到反应的条件,如可燃物需加热达到其着火点,铝热反应需高温,故B错误;
C.化学变化是生成新物质的变化,除有新物质生成外能量的变化,根据能量守恒定律反应前后总能量不变,反应物能量高于生成物时,多余的能量以热能、光能、电能等形式释放出来,反之,吸收能量变为化学能,故C错误;
D.化学反应的本质是旧化学键的断裂与新化学键的形成,断裂化学键需吸收能量,形成化学键需释放能量,旧化学键断裂吸收的能量与新化学键形成所释放的能量的相对大小决定了反应是放热还是吸热,故D错误;
故选A.
点评 本题考查了常见能量的转化形式、吸热反应和放热反应,注意掌握常见的放热反应、吸热反应以及放热、吸热的本质,题目难度不大.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
10. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成如表实验设计表(表中不要留空格).
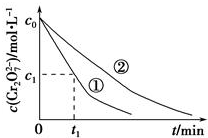
①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响(或溶液pH越小,反应速率越大);实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成下表中内容.[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定.]
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成如表实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响(或溶液pH越小,反应速率越大);实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成下表中内容.[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定.]
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
11.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:C(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:C(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
15.苯环结构中不存在C-C与C═C的简单交替排列结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯不能使溴水因化学反应而褪色
③经实验测定只有一种结构的邻二甲苯
④苯能在加热和催化剂条件下氢化成环己烷
⑤苯中相邻C原子与C原子间的距离都相等.
①苯不能使酸性KMnO4溶液褪色
②苯不能使溴水因化学反应而褪色
③经实验测定只有一种结构的邻二甲苯
④苯能在加热和催化剂条件下氢化成环己烷
⑤苯中相邻C原子与C原子间的距离都相等.
| A. | 只有①②③⑤ | B. | 只有④⑤ | C. | ①②③④⑤ | D. | 只有①② |
5.设NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 1mol氯气跟足量的NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 1mol Na2O含离子数为3NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |
9.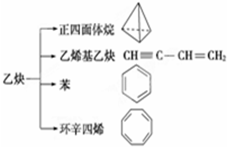 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )| A. | 正四面体烷的分子式为C4H4,其二氯代物有两种 | |
| B. | 苯为平面六边形结构,分子中存在C-C和C═C,能使酸性KMnO4溶液褪色 | |
| C. | 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同 | |
| D. | 环辛四烯跟苯的结构很像,不能使溴水褪色 |
3.有5种元素X、Y、Z、Q、T.X原子M层上有2个未成对电子且M层无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )
| A. | 元素Y和Q可形成化合物Y3Q4 | |
| B. | T和Z各有一种单质的空间构型为正四面体形,键角都是109°28? | |
| C. | X和Q结合生成的化合物可以形成离子化合物 | |
| D. | ZQ2是极性键构成的非极性分子 |