题目内容
19.研究表明,放射性元素镭、钍、锕在放射性衰变中都能形成质子数为86的三种不同原子,分别被称为“镭射气”、“钍射气”、“锕射气”,可分为表示为${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,下列说法错误的是( )| A. | 它们都具有放射性 | |
| B. | 尽管它们结构不同,但它们的化学性质相同 | |
| C. | 它们互为同分异构体 | |
| D. | 它们的原子最外层均为8电子 |
分析 A.放射性元素镭、钍、锕在放射性衰变中都能形成质子数为86的三种不同原子,分别被称为“镭射气”、“钍射气”、“锕射气”;
B.${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,质子数相同,最外层电子数相同,化学性质由最外层电子数决定;
C.分子式相同,结构不同的有机物互为同分异构体;
D.原子序数86,有6个电子层,最外层8个电子.
解答 解:A.放射性元素镭、钍、锕在放射性衰变中都能形成质子数为86的三种不同原子,分别被称为“镭射气”、“钍射气”、“锕射气”,${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,为放射性元素,故A正确;
B..${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,质子数相同,最外层电子数相同,化学性质由最外层电子数决定,尽管它们结构不同,但它们的化学性质相同,故B正确;
C.${\;}_{86}^{220}Rn$、${\;}_{86}^{222}Rn$、${\;}_{86}^{219}Rn$,是质子数相同中子数不同的同种元素的不同原子为同位素,不是同分异构体,故C错误;
D.原子序数86,有6个电子层,最外层8个电子,故D正确;
故选C.
点评 本题考查了原子结构、微粒关系、同位素、同分异构体等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
15.下列有关说法正确的是( )
| A. | HClO是弱酸,但NaClO强电解质 | |
| B. | HC1、SO2、HBr三种气体都可用浓硫酸干燥 | |
| C. | 向浓氨水中滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 | |
| D. | SO2和SO3都是酸性氧化物,两者的水溶液都是二元强酸 |
16.下列转化过程需要加入还原剂才能实现的是( )
| A. | Na→NaOH | B. | FeCl3→FeCl2 | C. | H2→H2O | D. | Cu→CuO |
7.第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量.
Ⅰ.CO2加氢合成甲醇是合理利用 CO2的有效途径.由 CO2制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应②:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1,回答下列问题:
(1)反应②的△H2=+41.19 kJ•mol-1,反应 ①自发进行条件是较低温(填“较低温”、“较高温”或“任何温度”).
(2)某温度下,在体积为2L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①.一段时间后达到平衡.
测得甲中CO2和CH3OH(g)的浓度随时间变化如图所示.
①前3min内,平均反应速率v(H2)=0.5mol•L-1•min-1.此温度下该反应的平衡常数为
5.33(结果保留两位小数).
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是D.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离
D.再充入1mol H2 E.再充入1mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡正向(填“正向”、“逆向”或“不”)移动.
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为1.5 mol/L<c≤2 mol/L.
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4).氨基甲酸铵极易发生:H2NCOONH4+2H2O?NH4HCO3+NH3•H2O,该反应酸性条件下更彻底.25℃,向l L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵.若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=0.1mol/L,NH4+水解常数Kh=4×10-9mol/L.
Ⅰ.CO2加氢合成甲醇是合理利用 CO2的有效途径.由 CO2制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应②:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1,回答下列问题:
(1)反应②的△H2=+41.19 kJ•mol-1,反应 ①自发进行条件是较低温(填“较低温”、“较高温”或“任何温度”).
(2)某温度下,在体积为2L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①.一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |

①前3min内,平均反应速率v(H2)=0.5mol•L-1•min-1.此温度下该反应的平衡常数为
5.33(结果保留两位小数).
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是D.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离
D.再充入1mol H2 E.再充入1mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡正向(填“正向”、“逆向”或“不”)移动.
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为1.5 mol/L<c≤2 mol/L.
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4).氨基甲酸铵极易发生:H2NCOONH4+2H2O?NH4HCO3+NH3•H2O,该反应酸性条件下更彻底.25℃,向l L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵.若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=0.1mol/L,NH4+水解常数Kh=4×10-9mol/L.
14.合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.
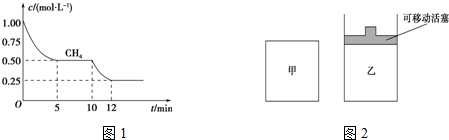
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
此时反应③中正、逆反应速率的关系是a(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.

(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
4.食品卫生与健康密切相关,下列做法会导致食品对人体有害的是( )
①有些食品加工厂将塑化剂添加到食品中 ②石灰水保存鲜鸡蛋
③为了使火腿肠颜色更鲜红,可以多加一些亚硝酸钠④蒸馒头时加入适量纯碱.
①有些食品加工厂将塑化剂添加到食品中 ②石灰水保存鲜鸡蛋
③为了使火腿肠颜色更鲜红,可以多加一些亚硝酸钠④蒸馒头时加入适量纯碱.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
11.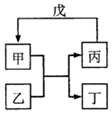 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.