题目内容
3.标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.3L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为$\frac{1000ρV}{VM+6720}$mol/L. (用含ρ、V、M的代数式表示,化简到最简整数比)分析 气体的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,气体质量=$\frac{V}{22.4}$mol×Mg/mol=$\frac{VM}{22.4}$g,水质量为300g,溶液质量=$\frac{VM}{22.4}$g+300g,溶液体积=$\frac{\frac{VM}{22.4}+300}{1000ρ}$L,根据c=$\frac{n}{V}$计算物质的量浓度.
解答 解:气体的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,气体质量=$\frac{V}{22.4}$mol×Mg/mol=$\frac{VM}{22.4}$g,水质量为300g,溶液质量=$\frac{VM}{22.4}$g+300g,溶液体积=$\frac{\frac{VM}{22.4}+300}{1000ρ}$L,c=$\frac{n}{V}$=
$\frac{\frac{V}{22.4}mol}{\frac{\frac{VM}{22.4}+300}{1000ρ}L}$=$\frac{1000ρV}{VM+6720}$mol/L,故答案为:$\frac{1000ρV}{VM+6720}$mol/L.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意溶液质量计算方法,题目难度不大.

练习册系列答案
相关题目
14.合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.
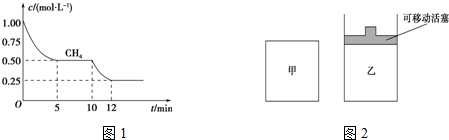
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
此时反应③中正、逆反应速率的关系是a(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.

(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
11.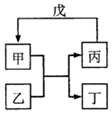 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
18.把17.1g Ba(OH)2固体分别加入到100mL 1mol/L的下列物质的溶液中,溶液导电能力变化最小的是( )
| A. | 醋酸 | B. | 碳酸钠溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
12.下列实验基本操作(或实验注意事项)中,主要出于实验安全考虑的是( )
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 滴管不能交叉使用 | |
| C. | 气体实验装置在实验前进行气密性检查 | |
| D. | 可燃性气体的验纯 |
13.两气体A和B的摩尔质量之比为2:1,则它们在同温、同压、同体积时的分子个数比应为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 4:1 |

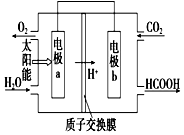 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.