题目内容
10.在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用.下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-36;Ksp(PbS)=8×10-28
③Ⅲ装置中电解硫酸钠溶液,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠.
(1)I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.
分析 由流程图可知反应I为NaClO3、Na2SO3在硫酸溶液中发生氧化还原反应生成C1O2,III中电解质是Na2SO4,电解Na2SO4溶液的本质是电解水,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠,所以a气体是氧气、b气体是氢气、A是NaOH,反应Ⅱ为C1O2与双氧水、NaOH溶液混合反应经过滤得到NaClO2溶液,NaClO2溶液采取蒸发浓缩、冷却结晶方法,通过过滤得到NaClO2•3H2O晶体,据此分析.
(1)由流程图可知I中目的是产生C1O2,SO32-具有还原性,将ClO3-还原为C1O2,自身被氧化为SO42-;
(2)从溶液中得到含结晶水的晶体,一般采取蒸发浓缩、冷却结晶方法,通过过滤得到粗晶体;
(3)①弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大;
②根据三者的溶度积结合物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀;最后析出沉淀是FeS,根据溶度积计算S2-的浓度;
(4)据图知,III中电解质是Na2SO4,电解Na2SO4溶液的本质是电解水,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠,则阳极上电极反应式为:2H2O-4e-=O2↑+4H+、阴极电极反应式为:2H2O+2e-=H2↑+2OH-,所以a气体是氧气、b气体是氢气、A是NaOH,根据电极反应计算转移电子的物质的量.
解答 解:(1)由流程图可知I中目的是产生C1O2,SO32-具有还原性,将ClO3-还原为C1O2,自身被氧化为SO42-,反应的离子方程式为:SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O;故答案为:SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O;
(2)从溶液中得到含结晶水的晶体,一般采取蒸发浓缩、冷却结晶方法,通过过滤得到粗晶体,所以操作顺序为:bdc;
故答案为:bdc;
(3)①根据电离平衡常数可知酸性强弱顺序为:HClO2>HF>H2CO3>HS-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等各溶液pH关系为:pH(Na2S)>pH(NaHCO3)>pH(NaF)>pH(NaClO2);
故答案为:pH(Na2S)>pH(NaHCO3)>pH(NaF)>pH(NaClO2);
②Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4×10-28,物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS;最后析出沉淀是FeS,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1),此时的S2-的浓度c(S2-)=$\frac{Ksp(FeS)}{c(Fe{\;}^{2+})}$=$\frac{6.3×10{\;}^{-18}}{10{\;}^{-5}}$mol/L=6.3×10-13mol/L;
故答案为:CuS;6.3×10-13mol/L;
(4)据图知,III中电解质是Na2SO4,电解Na2SO4溶液时,阳极区生成氧气同时产生硫酸,阴极区生成氢气同时产生氢氧化钠,则阳极上电极反应式为:2H2O-4e-=O2↑+4H+,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,左边流出硫酸,所以a气体是氧气,b气体是氢气、A是NaOH,A在阴极上生成,生成气体a的电极反应式:2H2O-4e-=O2↑+4H+,生成气体a的体积为1.12L(标准状况)即0.05mol,转移电子的物质的量为0.05mol×4=0.2mol;
故答案为:0.2mol.
点评 本题以学生比较陌生的亚氯酸钠制备为载体,考查学生阅读题目获取信息的能力、氧化还原反应原理、物质分离提纯、盐类水解、溶度积的有关计算与应用等,培养了学生综合运用知识解决问题的能力,题目难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 对Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),升高温度,其Ksp一定增大 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |
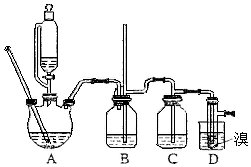 实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:
实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:有关数据列表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是d(填正确选项前的字母;
a、引发反应 b、加快反应速度 c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收乙烯中的酸性杂质气体;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是溴的颜色完全褪去.
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是防止倒吸、判断装置是否堵塞;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
(7)本实验中,1,2-二溴乙烷的产率为50%.
| A. | 0.02mol/L醋酸溶液与0.02mol/LKOH溶液等体积混合液 | |
| B. | 0.01mol/L醋酸溶液 | |
| C. | 0.03mol/L醋酸溶液与0.01mol/LKOH浓液等体积混合液 | |
| D. | pH=2的硝酸溶液与pH=12KOH溶液等体积混合液 |
| A. | HClO是弱酸,但NaClO强电解质 | |
| B. | HC1、SO2、HBr三种气体都可用浓硫酸干燥 | |
| C. | 向浓氨水中滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 | |
| D. | SO2和SO3都是酸性氧化物,两者的水溶液都是二元强酸 |
| A. | 影响化学反应速率的主要因素是内因,即反应物本身的性质 | |
| B. | 增大反应物浓度,活化分子百分数不变,单位体积内活化分子数增多 | |
| C. | 升高温度,活化分子百分数增大,分子有效碰撞的频率增大,化学反应速率加快 | |
| D. | 使用正催化剂,活化分子百分数不变,但是反应速率加快 |
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.
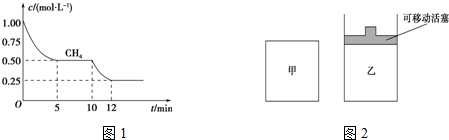
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
