题目内容
11.下列说法在一定条件下可以实现的是( )①酸性氧化物与碱发生反应②弱酸与盐溶液反应可以生成强酸③没有水生成,也没有沉淀和气体生成的复分解反应④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体.
| A. | ①②③④⑤⑥ | B. | ①②⑤⑥ | C. | ①②③⑤ | D. | ①②③⑤⑥ |
分析 ①MgO与盐酸反应生成盐和水;
②CuSO4+H2S═CuS↓+H2SO4为弱酸与盐的反应;
③HCl+CH3COONa=CH3COOH+NaCl为复分解反应,为强酸制取弱酸的反应;
④2H2S+H2SO3=3H2O+S↓反应后显中性;
⑤氧气转化为臭氧,无元素的化合价变化;
⑥二氧化碳与过氧化钠反应生成氧气.
解答 解:①MgO与盐酸反应生成盐和水,则酸性氧化物与碱发生反应可实现,故选;
②CuSO4+H2S═CuS↓+H2SO4为弱酸与盐的反应,则弱酸与盐溶液反应可以生成强酸可实现,故选;
③HCl+CH3COONa=CH3COOH+NaCl为复分解反应,为强酸制取弱酸的反应,则没有水生成,也没有沉淀和气体生成的复分解反应可发生,故选;
④2H2S+H2SO3=3H2O+S↓反应后显中性,则两种酸溶液充分反应后的溶液体系为中性,故选;
⑤氧气转化为臭氧,无元素的化合价变化,为非氧化还原反应,故选;
⑥二氧化碳与过氧化钠反应生成氧气,则两种氧化物反应的产物有气体可实现,故D选;
故选A.
点评 本题考查酸碱盐的反应,为高频考点,把握物质性质、发生的反应、常见的实例为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列关于平衡体系的各说法中不正确的是( )
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 对Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),升高温度,其Ksp一定增大 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |
2.下列有关影响化学反应速率的因素的说法错误的是( )
| A. | 影响化学反应速率的主要因素是内因,即反应物本身的性质 | |
| B. | 增大反应物浓度,活化分子百分数不变,单位体积内活化分子数增多 | |
| C. | 升高温度,活化分子百分数增大,分子有效碰撞的频率增大,化学反应速率加快 | |
| D. | 使用正催化剂,活化分子百分数不变,但是反应速率加快 |
16.下列转化过程需要加入还原剂才能实现的是( )
| A. | Na→NaOH | B. | FeCl3→FeCl2 | C. | H2→H2O | D. | Cu→CuO |
3.将amol/L Al2(SO4)3和钾离子浓度为2bmol/L的K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42-的浓度为( )
| A. | $\frac{(a+b)}{4}$ mol/L | B. | 4(3a+b) mol/L | C. | 4(a+b) mol/L | D. | $\frac{(3a+b)}{4}$mol/L |
14.合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.
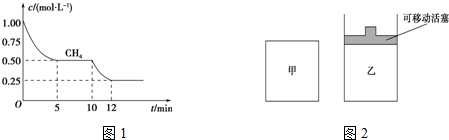
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
此时反应③中正、逆反应速率的关系是a(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度或充入水蒸气.

(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
①可以判断甲容器中反应已达平衡状态的是bd.
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是ab.
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3=-41.2kJ/mol kJ•mol-1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.

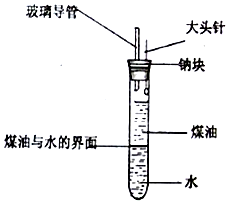 某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题: