题目内容
6.甲醇是21世纪应用最广泛的清洁燃料之一,通过下列反应可以制备甲醇:CO ( g )+2H2( g )?CH3OH ( l )△H
(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
(2)在容积可变的密闭容器中充入1mol CO ( g )和2molH2( g )生成CH3OH( g ),H2的平衡转
化率随温度(T)、压强(P)的变化如图1所示.
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4L.
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c(CO)的变化曲线.

分析 (1)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律计算反应CO ( g )+2H2 ( g )?CH3OH ( l )的焓变,写出热化学方程式;
(2)①反应自发进行的判断依据是△H-T△S<0,据此分析判断,压强一定温度越高平衡逆向进行,氢气的转化率减小;
②在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),A点氢气转化率0.5,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 2 0
变化量(mol) 0.5 1 0.5
平衡量(mol) 0.5 1 0.5
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
B点和A点温度不变平衡常数不变,结合三行计算列式计算平衡浓度,结合平衡常数计算气体体积;
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),图中中是甲醇的浓度增加,达到平衡状态甲醇浓度为0.8mol/L,据此计算甲醇反应速率,速率之比等于化学方程式计量数之比得到氢气的反应速率,计算平衡状态下CO的浓度,若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,改变条件后依据氢气的转化率列三行计算,得到平衡状态下一氧化碳的浓度,据此画出图象变化.
解答 解:(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$×②得反应CO(g)+2H2(g)=CH3OH(l),
该反应的反应热△H=-283.0kJ•mol-1+(-285.8kJ•mol-1)-$\frac{2}{3}$(-726.5kJ•mol-1)=-128.1kJ•mol-1,
即CO(g)+2H2(g)=CH3OH(l)△H=-128.1kJ•mol-1.
故答案为:-128.1kJ•mol-1;
(2)①CO ( g )+2H2 ( g )?CH3OH ( l ),反应为放热反应,△H<0,气体体积减小反应的熵变△S<0,图象中压强一定随温度升高,平衡逆向进行,氢气转化率减小,则T1<T2,
故答案为:<;<;
②在容积可变的密闭容器中充入1mol CO ( g ) 和2molH2 ( g )生成CH3OH( g ),A点氢气转化率0.5,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 2 0
变化量(mol) 0.5 1 0.5
平衡量(mol) 0.5 1 0.5
平衡常数K=$\frac{0.5}{0.5×{1}^{2}}$$\frac{\frac{0.5}{2}}{\frac{0.5}{2}×(\frac{1}{2})^{2}}$=4,
若达到平衡状态B 时转化率为0.8,结合平衡三行计算列式计算,
CO ( g )+2H2 ( g )?CH3OH (g )
起始量(mol) 1 2 0
变化量(mol) 0.8 1.6 0.8
平衡量(mol) 0.2 0.4 0.8
B点温度不变平衡常数不变,K=$\frac{\frac{0.8}{V(B)}}{\frac{0.2}{V(B)}×(\frac{0.4}{V(B)})^{2}}$=4
则容器的体积V(B)=0.4
故答案为:4,0.4;
(3)V(CH3OH)=$\frac{△c}{△t}$=$\frac{0.8mol/L}{10min}$=0.08mol/(L•min),根据方程式得V(CH3OH):V(H2)=1:2,所以V(H2)=2×0.08mol/(L•min)=0.16mol/(L•min);
2H2(g)+CO(g)=CH3OH(g)
起始量(mol/L) 3 1 0
变化量(mol/L) 1.6 0.8 0.8
平衡量(mol/L) 1.4 0.2 0.8
此时CO的平衡浓度为 0.2mol/L,
改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=$\frac{6mol}{2L}$×33.3%=1mol/L,
2H2(g)+CO(g)=CH3OH(g)
起始浓度(1mol/L) 3 1 0
转化浓度(1mol/L) 1 0.5 0.5
平衡浓度(1mol/L) 2 0.5 0.5
CO平衡浓度为0.5mol/L,15min时CO浓度为0.2mol/L.升温平衡逆向进行,一氧化碳物质的量浓度增大,据此画出变化曲线为: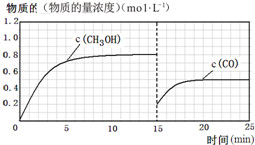 ,
,
故答案为:0.16mol•L-1•min-1; .
.
点评 本题考考查了热化学方程式和盖斯定律计算应用,平衡常数的计算及应用,影响平衡的因素分析判断,题目涉及的知识点较多,综合性较强,题目难度中等.

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案| A. | 过氧化钠可以用呼吸面具中供氧剂 | |
| B. | 氧化铝的熔点高,可用作耐火材料 | |
| C. | 铝热反应原理是炼铁最常见的反应原理 | |
| D. | 青铜是我国使用最早的合金 |
| 单质 | A | B | C | D | E |
| 最高价氧化物 对应水化物的稳定性 | 难分解 | 能分解 | 能分解 | 能分解 | 能分解 |
| 单质性质 | 与水剧烈反应 | 缓慢溶于热水 | 溶于强碱性溶液 | 难溶于冷的浓硝酸 | 溶于浓、稀硝酸 |
根据要求,回答下列问题:
(1)C元素最高价氧化物对应的水化物既能与酸反应,又能与碱反应,原因分别是:Al(OH)3?Al3++3OH-;Al(OH)3?H++AlO2-+H2O(用电离方程式表示)
(2)以B、C为电极,A的氢氧化物的水溶液为电解质溶液,构成原电池.写出C极的电极反应式:Al-3e-+4OH-=AlO2-+2H2O.
(3)用离子方程式表示D的单质能与D的化合物在水溶液中发生化合反应:Fe+2Fe3+=3Fe2+.
(4)E的单质在加热条件下能与浓硫酸反应,其反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
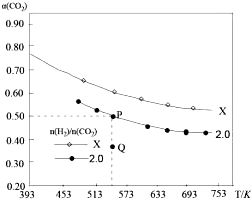 在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | X的氢碳比X>2.0,且Q点在氢碳比为2.0时v(正)<v(逆) | |
| C. | 若起始时,CO2、H2浓度分别为0.5mol/L和1.0mol/L,则可得到P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
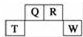 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: .
.