题目内容
3. 铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol-1(用含a、b的代数式表示).
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2═17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是防止Mg Al被空气氧化.
②在6.0mol•L-1 HCl溶液中,混合物Y能完全释放出H2.1mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为52mol.
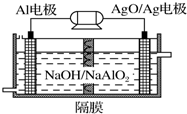
(3)铝电池性能优越,Al-AgO/Ag电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
分析 (1)将两个方程式相加即得目标方程式,焓变相应的改变;
(2)①镁、铝是亲氧元素,易被氧气氧化;
②释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(3)该原电池中,铝易失去电子作负极,则银是正极,负极上铝和氢氧化钠反应生成偏铝酸钠,正极上氧化银得电子生成银,据此写出电池反应式.
解答 解:(1)根据盖斯定律,将题中所给两方程式相加得Al2O3(s)+3C(s)=2Al(l)+3CO(g),对应的△H=(a+b)kJ•mol-1,
故答案为:a+b;
(2)①镁、铝都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化,故答案为:防止Mg Al被空气氧化;
②1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,故答案为:52mol;
(3)铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,氧化银做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,所以其电池反应式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,故答案为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
点评 本题以铝为题材,考查盖斯定律、铝及其化合物的性质以及电化学反应方程式,意在考查考生阅读新信息,处理新情况的能力,电极反应式的书写是易错点,难度较大.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
5.下列说法中错误的是( )
| A. | 离子晶体在熔化状态下能导电 | |
| B. | 在晶体中只要有阴离子就一定有阳离子 | |
| C. | 原子晶体中一定有非极性共价键 | |
| D. | 分子晶体中不一定含有共价键 |
14.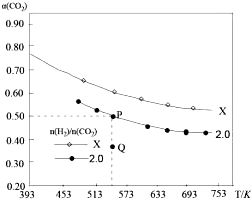 在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
 在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | X的氢碳比X>2.0,且Q点在氢碳比为2.0时v(正)<v(逆) | |
| C. | 若起始时,CO2、H2浓度分别为0.5mol/L和1.0mol/L,则可得到P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
8.同温同压下,下列各组热化学方程式中,△H1<△H2是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
13.下列说法正确的是( )
| A. | Al2O3固体不导电且难溶于水,所以Al2O3不是电解质 | |
| B. | Na2SO4溶液导电,所以Na2SO4是电解质 | |
| C. | 纯净的硫酸不导电,所以硫酸不是电解质 | |
| D. | 1.5mol/L的NaCl溶液与1.0mol/L的MgCl2溶液相比较,导电能力后者强 |
