题目内容
5.空气和水的污染是人类生存的重大问题.国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,2006年的新标准修订水中硝酸盐的含量为10毫克/升(与美国相同),考虑到全国各地的具体情况,又特别规定在使用地下水等条件受限时可放宽至20毫克/升.目前,消除大气和水中的污染有多种方法.(1)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图1:
①写出N2和O2反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1.
②氧化还原法消除氮氧化物的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2,反应Ⅱ中,当n(NO2):n[CO(NH2)2]=3:2时,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
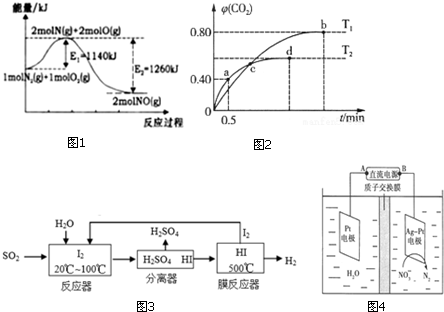
(2)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);不同温度下,向装有足量
I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的物质的量分数(CO2)随时间t变化曲线如图2.请回答下列问题:
①T2温度下,0.5min 内CO2的平均速率为0.8mol•L-1•min-1,T1时化学平衡常数K=1024.
②d点时,向恒容容器中充入2mol CO,再次平衡后,CO2的百分含量不变(增大、减小或不变)
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图3:
①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物氢气,有利于反应正向进行.
(4)催化反硝化法和电化学沉解法可用于治理水中硝酸盐的污染.
①催化反硝化法中,用H2将NO3-还原N2,一段时间后,溶液的碱性明显增强.则反应离子方程式为.
②电化学降解NO3-的原理如图4,电源正极为A(填“A”或“B),阴极反应式为.
分析 (1)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
②反应方程式中,化学计量数之比等于物质的量之比;
(2)①根据起始量和a点时CO2的体积分数(即物质量分数),列式计算即可求出从反应开始至a点时的反应速率为v(CO);根据b点时CO2的体积分数φ(CO2)求出CO和CO2的平衡浓度进而求出T1时化学平衡常数K;
②d点时,反应达到平衡状态,向恒容容器中充入2mol CO,相当于增大容器中压强,压强增大对平衡无影响;
(3)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②HI分解是可逆反应,分离出氢气有利于平衡正向移动;
(4)①用H2 将NO3- 还原为,一段时间后,溶液的碱性明显增强,生成氢氧根离子硝酸根离子被还原为氮气,结合电荷守恒配平书写离子方程式;
②由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成;
解答 解:(1)①该反应中的反应热=反应物的键能和-生成物的键能和=1140-1260=-120kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的化学计量数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)①a点时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)=$\frac{x}{2}$=0.40,得x=0.8mol
则从反应开始至a点时的反应速率为v(CO2)=$\frac{\frac{0.8mol}{2L}}{0.5min}$=0.8mol•L-1•min-1,
故答案为:0.8mol•L-1•min-1;
②T1时:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
转化量/mol y y
b点量/mol 4-y y
根据b点时CO2的体积分数φ(CO2)=$\frac{y}{4}$=0.80,
得y=3.2mol,c(CO)=0.4mol•L-1,c(CO2)=1.6mol•L-1
T1时化学平衡常数K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$=$\frac{1.{6}^{5}}{0.{4}^{5}}$=1024,
故答案为:0.8mol•L-1•min-1;1024;
②d点时,反应达到平衡状态,5CO(g)+I2O5(s)?5CO2(g)+I2(s),反应前后气体体积不变,向恒容容器中充入2mol CO,相当于压强增大,对平衡无影响,平衡不变,CO2的百分含量不变,
故答案为:不变;
(3)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行,
故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
(4)①用H2 将NO3- 还原为,一段时间后,溶液的碱性明显增强,生成氢氧根离子硝酸根离子被还原为氮气,结合电荷守恒配平书写离子方程式2NO3-+3H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O;
故答案为:2NO3-+3H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O;
②由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有水生成,
所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:A,2NO3-+12H++10e-=N2+6H2O.
点评 本题综合考查化学反应速率和化学平衡常数的相关计算、化学平衡移动原理,为高考常见题型,侧重于学生的分析能力和计算能力的考查,综合性很强,难度较大,注意把握化学平衡常数的计算以及平衡移动的影响.

| A. | 铝粉的作用是点燃时可以置换出氧气 | |
| B. | 在反应中NH4ClO4仅起到氧化剂作用 | |
| C. | 该反应属于分解反应,也属于氧化还原反应 | |
| D. | 上述反应瞬间能产生高温,高温是推动飞船飞行的主要因素 |
| A. | 过氧化钠可以用呼吸面具中供氧剂 | |
| B. | 氧化铝的熔点高,可用作耐火材料 | |
| C. | 铝热反应原理是炼铁最常见的反应原理 | |
| D. | 青铜是我国使用最早的合金 |
| A. | 离子晶体在熔化状态下能导电 | |
| B. | 在晶体中只要有阴离子就一定有阳离子 | |
| C. | 原子晶体中一定有非极性共价键 | |
| D. | 分子晶体中不一定含有共价键 |
| A. | 氯原子的结构示意图: | B. | 氯化镁的电子式: | ||
| C. | N2的电子式: | D. | 氯化氢分子的形成过程: |
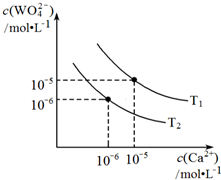 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:Ⅰ.WO42ˉ(aq)+Ca(OH)2(s)?CaWO4(s)+2OHˉ(aq) K1
已知:反应Ⅰ的平衡常数K1理论值如下表
| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
(1)判断反应Ⅰ的△S>0、△H>0(填“>”、“=”或“<”),在较高(填“较高”或“较低”)温度下有利于该反应自发进行.
(2)氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,溶解度均随温度升高而减小.它们在水中存在如下沉淀溶解平衡:
Ⅱ.CaWO4(s)?Ca2+(aq)+WO42ˉ(aq) K2
Ⅲ.Ca(OH)2(s)?Ca2+(aq)+2OHˉ(aq) K3
①根据反应Ⅰ~Ⅲ,可推导出K1、K2与K3之间的关系,则K1=K1=$\frac{{K}_{3}}{{K}_{2}}$(用K2、K3表示).
②根据反应Ⅱ,图为不同温度下CaWO4的沉淀溶解平衡曲线.则T1<T2(填“>”“=”或“<”).T1时,向0.5mol•Lˉ1钨酸钠的碱性溶液中,加入适量Ca(OH)2,反应达到平衡后WO42ˉ的转化率为60%,此时溶液中c(Ca2+)=5×10ˉ10mol•Lˉ1.(假设反应前后体积不变)
(3)制取钨酸钙时,适时向反应混合液中添加适量的某种酸性物质,有利于提高WO42ˉ的转化率.反应后过滤,再向滤液中通CO2,进一步处理得到Na2CO3.
①在反应混合液中不直接通入CO2,其理由是碱性条件下CO2与Ca2+生成难溶物CaCO3,降低WO42ˉ的转化率;
②用平衡移动原理解释添加酸性物质的理由加入酸性物质与OHˉ反应,使溶液中OHˉ浓度减小,平衡向生成CaWO4的方向移动.
| 单质 | A | B | C | D | E |
| 最高价氧化物 对应水化物的稳定性 | 难分解 | 能分解 | 能分解 | 能分解 | 能分解 |
| 单质性质 | 与水剧烈反应 | 缓慢溶于热水 | 溶于强碱性溶液 | 难溶于冷的浓硝酸 | 溶于浓、稀硝酸 |
根据要求,回答下列问题:
(1)C元素最高价氧化物对应的水化物既能与酸反应,又能与碱反应,原因分别是:Al(OH)3?Al3++3OH-;Al(OH)3?H++AlO2-+H2O(用电离方程式表示)
(2)以B、C为电极,A的氢氧化物的水溶液为电解质溶液,构成原电池.写出C极的电极反应式:Al-3e-+4OH-=AlO2-+2H2O.
(3)用离子方程式表示D的单质能与D的化合物在水溶液中发生化合反应:Fe+2Fe3+=3Fe2+.
(4)E的单质在加热条件下能与浓硫酸反应,其反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
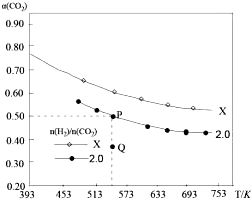 在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | X的氢碳比X>2.0,且Q点在氢碳比为2.0时v(正)<v(逆) | |
| C. | 若起始时,CO2、H2浓度分别为0.5mol/L和1.0mol/L,则可得到P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |