题目内容
16.如图是元素周期表的一部分,回答下列问题.
(1)⑨在周期表中的位置是第三周期ⅦA族;
(2)⑥对应的气态氢化物沸点高于同主族元素对应的气态氢化物,原因是HF分子间存在氢键,氢键强于范德华力;
(3)①⑤两元素可以形成原子个数比1:1和2:1的化合物X和Y,其中X的电子式为
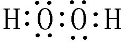 ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程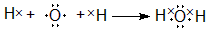 ;
;(4)实验室制取④的最简单氢化物的化学反应方程式是:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,写出Z发生催化氧化的反应方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
分析 由元素在周期表的位置可知,①~⑩分别为H、Be、C、N、O、F、Na、Al、Cl、Ar,
(1)⑨为Cl,原子结构中有3个电子层,最外层电子数为7;
(2)HF分子间含氢键,沸点高;
(3)①⑤两元素可以形成原子个数比1:1和2:1的化合物X和Y,X为H2O2,Y为H2O,均为共价化合物;
(4)铵盐与碱加热制备氨气;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,Z为乙醇,催化氧化生成乙醛.
解答 解:由元素在周期表的位置可知,①~⑩分别为H、Be、C、N、O、F、Na、Al、Cl、Ar,
(1)⑨在周期表中的位置是第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)⑥对应的气态氢化物沸点高于同主族元素对应的气态氢化物,原因是HF分子间存在氢键,氢键强于范德华力,故答案为:HF分子间存在氢键,氢键强于范德华力;
(3)①⑤两元素可以形成原子个数比1:1和2:1的化合物X和Y,X为H2O2,Y为H2O,均为共价化合物,X的电子式为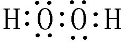 ,用电子式表示Y的形成过程为
,用电子式表示Y的形成过程为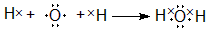 ,故答案为:
,故答案为: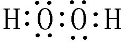 ;
;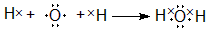 ;
;
(4)实验室制取④的最简单氢化物的化学反应方程式是Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(5)由①③⑤三种元素组成的化合物之一Z,是生活中常见的有机化合物,它具有特殊的香味,Z为乙醇,催化氧化生成乙醛,则Z发生催化氧化的反应方程式为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

 依据事实,写出下列反应的热化学方程式.
依据事实,写出下列反应的热化学方程式.(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O.已知室温下2g SiH4自燃放出热量89.2kJ.SiH4自燃的热化学方程式为SiH4(g)+2O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol
(2)化学反应N2+3H2?2NH3的能量变化如图所示,试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1
(3)已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
| O═O | H-H | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
| A. | 只含有2个双键的直链有机物 | B. | 含1个双键的直链有机物 | ||
| C. | 含1个双键的环状有机物 | D. | 含一个三键的直链有机物 |
| 操作及预期现象 | 结论 | |
| A | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 向某无色溶液滴加硝酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | A1箔插入稀HNO3中,无现象 | A1箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+无K+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | CSO的电子式: | |
| B. | Cl-的结构示意图: | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl | |
| D. | 苯分子的球棍模型: |



 .
.