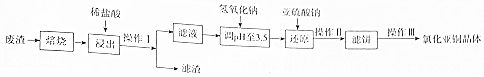
题目内容
1.上列各组离子能大量共存的是( )| A. | Na+、Mg2+、OH-、C1- | B. | Ba2+、K+、CO32-、NO3- | ||
| C. | Na+、K+、C1-、HCO3- | D. | H+、Na+、C1-、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Mg2+、OH-结合生成沉淀,不能共存,故A不选;
B.Ba2+、CO32-结合生成沉淀,不能共存,故B不选;
C.该组离子之间不反应,可大量共存,故C选;
D.H+、OH-结合生成水,不能共存,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
11.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
(1)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L•min);
(2)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
①此时刻v正大于v逆(填“大于”“小于”或“等于”)
②平衡时二甲醚的物质的量浓度是1.6mol/L.
(3)以二甲醚、空气、硫酸溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OCH3-12e-+3H2O═2CO2+12H+;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL 2mol/LCuSO4溶液,通电0.50min后,计算理论上可析出氧气的体积(标准状况)为1.68L.
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
(1)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L•min);
(2)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.8 | 1.24 | 1.24 |
②平衡时二甲醚的物质的量浓度是1.6mol/L.
(3)以二甲醚、空气、硫酸溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OCH3-12e-+3H2O═2CO2+12H+;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL 2mol/LCuSO4溶液,通电0.50min后,计算理论上可析出氧气的体积(标准状况)为1.68L.
12.一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大 |
16.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸,过滤、洗涤、干燥 |
| D | 用CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,然后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
6.下列物质不属于电解质的是( )
| A. | 硫酸 | B. | 氢氧化钠 | C. | 硝酸钾 | D. | 铜 |
13.反应3Fe(s)+4H2O(g)═Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加Fe的物质的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 升高温度 | |
| D. | 压强不变,充入Ne使容器的体积增大 |
10.某同学为研究电化学原理,使用KCl盐桥设计如图所示实验装置.下列分析不合理的是( )
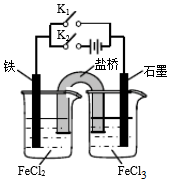

| A. | 闭合K1断开K2,左侧烧杯中的FeCl2溶液浓度逐渐增大 | |
| B. | 闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 | |
| C. | 闭合K1断开K2,电流从石墨电极经过K1流向铁电极 | |
| D. | 无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-=Fe2+ |