题目内容
6.下列物质不属于电解质的是( )| A. | 硫酸 | B. | 氢氧化钠 | C. | 硝酸钾 | D. | 铜 |
分析 在水溶液里或融融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不能导电的化合物是非电解质,无论是电解质还是非电解质都必须是化合物,据此分析.
解答 解:A、硫酸在溶于水能导电,属于电解质,故A不选;
B、氢氧化钠在溶于水或熔融状态下均能导电,属于电解质,故B不选;
C、硝酸钾在溶于水或熔融状态下均能导电,属于电解质,故C不选,
D、铜是单质,既不是电解质也不是非电解质,故D选;
故选:D.
点评 本题考查了电解质和非电解质的概念,难度不大,注意电解质和非电解质的区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.表列出了①~⑥七种元素在周期表中的位置.
请按要求回答下列问题:
(1)①元素符号是C.
(2)元素⑤的原子结构示意图是 .
.
(3)③、④两种元素的金属性强弱关系:③>④(填“>”或“<”).
(4)元素②、⑥的气态氢化物的稳定性较强的是H2O(填化学式).
| IA | 0 | ||||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
(1)①元素符号是C.
(2)元素⑤的原子结构示意图是
 .
.(3)③、④两种元素的金属性强弱关系:③>④(填“>”或“<”).
(4)元素②、⑥的气态氢化物的稳定性较强的是H2O(填化学式).
1.上列各组离子能大量共存的是( )
| A. | Na+、Mg2+、OH-、C1- | B. | Ba2+、K+、CO32-、NO3- | ||
| C. | Na+、K+、C1-、HCO3- | D. | H+、Na+、C1-、OH- |
11.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、W在周期表的相对位置如图所示.X元素的最简单氢化物甲能使湿润的红色石蕊试纸变蓝,W元素是海水溶质中的一种主要的元素,X和Y同周期,Y与Z的最外层电子数之和与W的最外层电子数相等.请回答下列问题:
(1)W位于周期表中的位置第三周期第VIIA族.
(2)Z和W组成物质的电子式是 .
.
(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| X | |||
| W |
(2)Z和W组成物质的电子式是
 .
.(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
18.下列有关物质的量的叙述,错误的是( )
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | 物质的量表示含有一定数目粒子的集体 | |
| C. | 物质的量是国际单位制中的一个基本单位 | |
| D. | 摩尔是计量原子、分子或离子等微观粒子的“物质的量”的单位 |
15.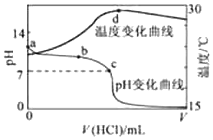 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
16.下列关于钠的说法中,不正确的是( )
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 自然界中钠只能以化合物的形式存在 | |
| C. | 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |